Анатомия сердца
Сердце — ключевой орган сердечно-сосудистой системы, отвечающий за перекачивание крови. Оно расположено в грудной полости: две трети слева от грудины и одна треть справа. Сердце не прикреплено к стенкам грудной клетки, а «подвешено» на крупных сосудах. Оно соседствует с легкими, диафрагмой и передней стенкой грудной клетки. Правая часть сердца контактирует с органами средостения.
Анатомические ориентиры сердца:
- Основание сердца — верхняя, широкая часть, откуда выходят крупные сосуды для подачи и отвода крови.
- Вершина сердца — нижняя, узкая часть, направленная вниз, влево и вперед относительно основания.
- Венечная борозда — поперечная борозда чуть ниже основания, в которой проходит венечная артерия, отделяющая предсердия от желудочков.
Сердце имеет форму конуса или пирамиды с широким основанием и вершиной, направленной вниз, вперед и влево. В этом направлении располагается электрическая ось сердца, о которой будет рассказано позже.
Структура сердца включает:
- камеры сердца;
- стенки сердца;
- проводящие волокна;
- клапаны сердца;
- фиброзный каркас;
- сердечную сумку;
- коронарные сосуды.
Врачи подчеркивают, что инфаркт миокарда является одной из самых серьезных сердечно-сосудистых патологий, требующих немедленного внимания. Основными причинами этого состояния являются атеросклероз, высокое артериальное давление, курение и диабет. Симптомы могут варьироваться, но чаще всего пациенты жалуются на сильную боль в груди, одышку и потливость. Важно отметить, что у женщин симптомы могут быть менее выраженными, что затрудняет диагностику. Для подтверждения диагноза используются электрокардиограмма, анализы крови и коронарная ангиография. Лечение включает как медикаментозную терапию, так и хирургические вмешательства, такие как стентирование или шунтирование. Врачи настоятельно рекомендуют регулярные профилактические осмотры и здоровый образ жизни для снижения риска развития инфаркта.

Камеры сердца
Сердце человека состоит из четырех камер, через которые кровь перекачивается благодаря сокращениям стенок и работе клапанов. Кровь движется в одном направлении, не возвращаясь в предыдущую камеру. В сердце начинаются и завершаются два круга кровообращения: большой и малый. Ритм сокращений включает систолу и диастолу.
Систола — это сокращение мышц камеры, в результате которого ее объем уменьшается, и кровь выбрасывается дальше. В диастолу мышцы расслабляются, и камера заполняется новой порцией крови. Систола требует значительных энергетических затрат, так как сердечная мышца использует кислород для перекачивания крови. Диастола — пассивный процесс, происходящий без затрат энергии. При расслаблении мышцы стенки возвращаются в исходное состояние, а создаваемое отрицательное давление внутри камеры способствует всасыванию новой порции крови.
Камеры человеческого сердца:
- Правое предсердие. Находится в верхней правой части сердца. В диастолу заполняется венозной кровью из верхней и нижней полых вен, завершая большой круг кровообращения. Во время систолы кровь выбрасывается в правый желудочек. Межпредсердная перегородка отделяет его от левого предсердия.
- Правый желудочек. Расположен в правой нижней части сердца. В диастолу заполняется кровью из правого предсердия, а в систолу выбрасывает кровь в легочную артерию, инициируя малый круг кровообращения. Объем правого желудочка меньше, чем у левого, и давление в нем ниже из-за меньшего сопротивления сосудов в малом круге.
- Левое предсердие. Находится в верхней левой части сердца. В диастолу заполняется артериальной кровью из легочных вен, а в систолу кровь выбрасывается в левый желудочек, завершая малый круг кровообращения.
- Левый желудочек. Это самая большая камера сердца. В диастолу получает кровь из левого предсердия, а в систолу выбрасывает ее в аорту, что запускает большой круг кровообращения. Артериальная кровь из этой камеры разносит кислород по всем артериям организма. При инфаркте миокарда чаще всего страдает левый желудочек.
Малый круг кровообращения — это сеть сосудов легких, где происходит газообмен и преобразование венозной крови в артериальную. Большой круг охватывает артерии и вены внутренних органов и тканей, обеспечивая их питание. Поскольку кровеносная система образует замкнутый контур, нарушения в работе одной из камер (например, сужение, расширение, застой крови и т.д.) со временем скажутся на функционировании остальных частей сердца.
| Признак/Фактор | Описание | Действия |
|---|---|---|
| Причины инфаркта миокарда | Атеросклероз коронарных артерий (накопление холестерина и бляшек), тромбоз (образование сгустка крови, блокирующего артерию), спазм коронарных артерий, гипертония, диабет, курение, ожирение, наследственность, стресс | Изменение образа жизни (диета, физическая активность, отказ от курения), контроль артериального давления и уровня сахара в крови, медикаментозная терапия (статины, антиагреганты) |
| Симптомы инфаркта миокарда | Давящая, сжимающая боль в груди (стенокардия), боль, иррадиирующая в левую руку, шею, челюсть, спину, одышка, тошнота, рвота, потливость, головокружение, слабость, чувство тревоги | Немедленный вызов скорой помощи |
| Признаки инфаркта миокарда (объективные) | Бледность кожи, учащенное сердцебиение (тахикардия), низкое артериальное давление (гипотония), шумы в сердце, изменения на ЭКГ | Госпитализация, мониторинг состояния пациента |
| Диагностика инфаркта миокарда | ЭКГ (изменения сегмента ST), анализ крови (маркеры повреждения миокарда — тропонин, креатинфосфокиназа), коронарография (рентгенологическое исследование коронарных артерий) | Постановка диагноза, определение степени поражения миокарда |
| Лечение инфаркта миокарда | Тромболитическая терапия (растворение тромба), ангиопластика (расширение коронарной артерии с помощью баллона), стентирование (установка стента для поддержания проходимости артерии), медикаментозная терапия (нитраты, бета-блокаторы, ингибиторы АПФ, статины, антиагреганты), реабилитация | Восстановление кровотока, снижение риска повторного инфаркта, улучшение качества жизни |
Стенки сердца
Стенки камер сердца состоят из трех слоев, в которых находятся волокна проводящей системы. Толщина стенок варьируется в разных камерах, и понимание их структуры важно для осознания механизма инфаркта миокарда.
Слои стенок сердца:
-
Эндокард. Этот слой толщиной 0,5 – 0,6 мм выстилает камеры сердца и состоит в основном из соединительной ткани. Эндокард образует створки клапанов и сухожильные нити, контролирующие их работу. Он обеспечивает равномерное движение крови в полостях сердца (ламинарное течение), предотвращая завихрения и тромбообразование.
-
Миокард. Миокард — мышечный слой, отвечающий за сокращения сердца. Он состоит из кардиомиоцитов, которые обеспечивают механическое сокращение и передачу биоэлектрических импульсов, что критично для согласованного сокращения камер. Миокард предсердий не соединен с миокардом желудочков, что позволяет импульсам распространяться последовательно: сначала сокращаются предсердия, затем желудочки. Это необходимо для эффективного перекачивания крови. Кардиомиоциты во время систолы потребляют кислород из коронарных сосудов и чувствительны к его недостатку, что может привести к ишемии (кислородному голоданию) и некрозу (гибели). Толщина миокарда наибольшая в стенках левого желудочка и наименьшая в предсердиях, что связано с давлением крови во время систолы.
-
Эпикард. Этот слой соединительной ткани оборачивает миокард снаружи и прочно с ним соединен. Эпикард охватывает места выхода крупных сосудов, где переходит в перикард (сердечную сумку). Его также называют висцеральным листком перикарда.
Инфаркт — это область в миокарде, где в течение определенного времени не поступало достаточное количество кислорода. Обычно такая зона располагается в стенке левого желудочка, требующего наибольшего количества энергии. Инфаркт правого желудочка встречается реже. На стадии ишемии говорят об ишемической болезни сердца, а при гибели клеток — об инфаркте. Со временем погибшие клетки растворяются, и на их месте формируется постинфарктный рубец из плотной соединительной ткани.
Инфаркт миокарда — это серьезное заболевание, которое вызывает множество обсуждений среди людей. Основные причины его возникновения включают атеросклероз, высокое кровяное давление, курение и диабет. Симптомы часто проявляются в виде сильной боли в груди, одышки, потливости и тошноты. Многие отмечают, что при первых признаках стоит немедленно обратиться за медицинской помощью, так как время играет решающую роль. Диагностика включает электрокардиограмму и анализы крови, которые помогают определить степень повреждения сердца. Лечение может варьироваться от медикаментозной терапии до хирургических вмешательств, таких как коронарное шунтирование. Важно помнить, что профилактика, включая здоровый образ жизни и регулярные медицинские осмотры, может значительно снизить риск развития этой патологии.

Проводящие волокна
Проводящая система сердца — это комплекс узлов и путей, генерирующих и передающих биоэлектрические импульсы по миокарду, вызывая сокращение мышечных клеток. Сбои в проведении импульсов могут привести к аритмии, при которой сокращения камер сердца происходят несогласованно, замедляя перекачивание крови.
Составляющие проводящей системы сердца:
- Синоатриальный узел. Находится рядом с впадением полых вен в правое предсердие и устанавливает ритм сердечных сокращений (60 – 80 ударов в минуту). Если импульс возникает здесь и распространяется по проводящей системе, ритм называется синусовым.
- Межпредсердный пучок Бахмана. Передает импульс к миокарду левого предсердия.
- Межузловые тракты Бахмана, Венкебаха и Тореля. Проходят в миокарде правого предсердия и передают импульс к атриовентрикулярному узлу.
- Атриовентрикулярный узел. Находится на стыке камер сердца и может генерировать более медленный ритм, если синоатриальный узел не вырабатывает импульсы. Процесс проведения импульса через узел замедлен, что создает паузу между сокращениями предсердий и желудочков, позволяя крови перейти в следующую камеру.
- Пучок Гиса. Распространяет импульс от атриовентрикулярного узла по миокарду желудочков. Состоит из правой и левой ножки (у левой также выделяют левую заднюю ветвь). В миокарде левого желудочка больше проводящих путей, так как он массивнее. В норме сокращение обоих желудочков происходит одновременно.
Импульс распространяется от синоатриального узла вперед, влево и вниз, что соответствует электрической оси сердца. Это общее направление для всех проводящих путей, рассматриваемое как сумма векторов (что фиксируется в электрокардиографии).
Блокада — это прекращение или значительное замедление проведения импульсов на определенном участке, например, в атриовентрикулярном узле или на уровне левой ножки пучка Гиса. Она может возникнуть при инфаркте миокарда, если зона некроза затрагивает клетки проводящей системы.
При наличии рубца или ишемии проводимость миокарда изменяется. Погибшие клетки хуже проводят импульсы, и этот участок не сокращается одновременно с остальным миокардом. Если некроз затрагивает ветви проводящей системы, могут возникать аритмии.
Клапаны сердца
Клапаны сердца обеспечивают правильное направление кровотока между камерами сердца. Хотя они не являются основными факторами инфаркта миокарда, могут способствовать ишемическим процессам. Структура клапанов включает фиброзное кольцо и створки, которые открываются в одном направлении и не закрываются обратно благодаря сухожильным нитям, соединенным с сосочковыми мышцами внутри желудочков. Повреждение сосочковых мышц и сухожилий при инфаркте может нарушить работу клапанов.
В сердце четыре основных клапана:
- трехстворчатый клапан – между правым предсердием и желудочком;
- клапан легочной артерии – на выходе из правого желудочка;
- митральный клапан – между левым предсердием и желудочком;
- аортальный клапан – на выходе из левого желудочка.
Наиболее распространенные проблемы с клапанами – стеноз и недостаточность. Стеноз – это сужение клапана, препятствующее нормальному кровотоку. Например, стеноз аортального клапана может не позволить всей крови, выбрасываемой левым желудочком, попасть в аорту, что повышает давление в камере и увеличивает нагрузку на миокард, способствуя инфаркту. Недостаточность клапана означает, что он не выполняет свои функции должным образом. В этом случае левый желудочек заполняется не только кровью из предсердия, но и частью крови, возвращающейся из аорты, что уменьшает объем крови в большом круге кровообращения и может вызывать симптомы сердечной недостаточности.

Фиброзный каркас
Фиброзный каркас — это пластина соединительной ткани, расположенная перпендикулярно оси сердца, разделяющая предсердия и желудочки. Он формирует кольца для митрального и трехстворчатого клапанов, к которым прикрепляются мышечные волокна. Эта структура обеспечивает передачу электрических импульсов с предсердий на желудочки исключительно через атриовентрикулярный узел, а не по мышечной ткани. Основные функции фиброзного каркаса — разделение мышечных массивов и служение основой для прикрепления мышечных волокон и клапанов.
Сердечная сумка
Сердечная сумка, или перикард, — это внешняя оболочка сердца, не прочно соединенная с органом. Перикард продолжается в эпикард, париетальный листок из соединительной ткани. Он отделяет сердце от легких и других органов грудной полости. Между перикардом и эпикардом находится полость перикарда с небольшим количеством жидкости, что снижает трение между листками и облегчает сокращение сердца.
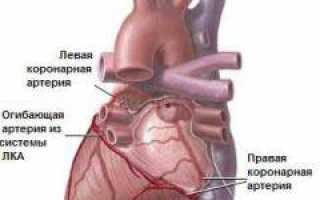
Коронарные сосуды
Коронарные артерии снабжают миокард кровью и часто становятся причиной инфаркта миокарда. Они начинаются от аорты сразу после выхода из левого желудочка, располагаются в венечной борозде и, разделяясь на ветви, проникают к стенкам сердца.
Основные коронарные артерии:
- левая КА (делится на несколько ветвей);
- правая КА (движется по стенке правого предсердия к задней поверхности сердца);
- передняя межжелудочковая ветвь (от левой КА, проходит по передней стенке желудочков);
- огибающая ветвь (от левой КА, располагается по стенке левого предсердия);
- диагональная ветвь (от огибающей, встречается не всегда);
- задние нисходящие ветви огибающей артерии (идут вниз по задней стенке левого желудочка);
- задняя нисходящая ветвь правой КА (спускается по задней стенке правого желудочка).
Закупорка или сужение ветвей коронарных артерий ухудшает кровоснабжение миокарда, что часто приводит к инфаркту. Коронарные артерии имеют множество коллатералей — небольших сосудистых соединений, которые связывают бассейны крупных ветвей и частично поддерживают жизнеспособность миокарда при сужении одной из артерий. Некроз клеток возникает при недостаточном кровоснабжении через коллатерали.
После инфаркта, даже без хирургического вмешательства, коронарный кровоток восстанавливается. Формируются новые соединения между бассейнами нескольких ветвей, обеспечивающие кровоснабжение жизнеспособных участков миокарда.
Причины инфаркта миокарда
В настоящее время известно, что инфаркт миокарда может возникать по различным причинам, часто как осложнение других заболеваний. Все эти причины объединяет механизм, приводящий к ухудшению кровоснабжения миокарда. Остановка кровотока вызывает гибель кардиомиоцитов и замещение поврежденной области соединительной тканью. В патофизиологии выделяют несколько ключевых факторов, способствующих этому заболеванию.
Ухудшение или прекращение кровоснабжения миокарда может быть вызвано следующими факторами:
- Сужение коронарной артерии. Коронарные артерии равномерно распределяют кислород по сердечной мышце. Их сужение приводит к недостаточному поступлению крови и ишемии миокарда. Постепенное сужение может вызвать ишемическую болезнь сердца (ИБС), проявляющуюся стенокардией. Сужение может быть вызвано спазмом, при котором расслабление мышц восстанавливает кровоток, или утолщением внутреннего слоя сосудов, что приводит к необратимому сужению.
- Тромбоз коронарной артерии. Блокировка кровотока тромбом может происходить постепенно в просвете сосуда или быть перенесена из других сосудов (эмболия). В обоих случаях возникает препятствие в коронарной артерии, что резко снижает кровоток и быстро приводит к гибели кардиомиоцитов.
- Повышенные потребности в кислороде. Коронарные сосуды обычно имеют резерв для доставки кислорода, расширяясь при физической нагрузке. Однако в редких случаях потребности миокарда в кислороде могут превышать возможности коронарных артерий, что также может привести к инфаркту.
Эти три механизма универсальны для всех причин инфаркта миокарда и объясняют гибель кардиомиоцитов. Они могут возникать при различных патологиях, которые в данном случае являются первопричинами заболевания.
Чаще всего инфаркт миокарда развивается на фоне следующих патологий:
- атеросклероз;
- воспалительные заболевания коронарных артерий;
- травмы;
- утолщение стенки артерий;
- эмболия коронарных артерий;
- несоответствие между потребностями миокарда и поставкой кислорода;
- нарушения в системе свертывания крови;
- послеоперационные осложнения;
- аномалии развития коронарных артерий.
Атеросклероз
Атеросклероз — заболевание, поражающее внутреннюю оболочку артерий (интиму). При определенных условиях в ней накапливаются жиры, в частности холестерин, клетки крови и другие вещества, что приводит к образованию атеросклеротической бляшки. Это сужает просвет сосуда и ухудшает кровоток. Атеросклероз является одним из самых распространенных заболеваний сердечно-сосудистой системы и основной причиной инфаркта миокарда.
Чаще всего атеросклероз коронарных артерий наблюдается у пожилых людей. Это связано с факторами окружающей среды, такими как избыток животных жиров в рационе и курение. Формирование атеросклеротических бляшек требует времени — годы или даже десятилетия.
По статистике, атеросклеротические изменения выявляются у 95% пациентов, перенесших инфаркт миокарда. У 55-70% таких пациентов поражены две и более коронарные артерии. Бляшка обычно образуется в крупной артерии и может оторваться, закупоривая одну из ее ветвей.
Исследуются следующие причины атеросклероза:
- нарушения жирового обмена;
- наследственная предрасположенность;
- курение;
- избыточный вес;
- высокое артериальное давление;
- диабет;
- малоподвижный образ жизни;
- другие хронические заболевания, влияющие на обмен жиров.
Выявить атеросклероз до инфаркта миокарда возможно. Бляшки формируются постепенно, и пациенты часто страдают от ишемической болезни сердца и приступов стенокардии. Важно обратиться к врачу и пройти обследования. Если выявлены значительные сужения в коронарных артериях, возможно хирургическое вмешательство, такое как стентирование или шунтирование сосудов, что поможет восстановить кровоснабжение миокарда и предотвратить инфаркт.
Воспалительное поражение коронарных артерий
Воспалительный процесс сопровождается отеком и утолщением тканей, иногда — склерозом. Если воспаление затрагивает внутреннюю оболочку артерий, это называется артериитом. Он приводит к сужению просвета сосуда и уменьшению объема крови, поступающей к сердечной мышце. При повышенной потребности сердца в кислороде может произойти инфаркт. Артерииты коронарных артерий как причина инфаркта миокарда встречаются редко. Воспаление может быть вызвано инфекциями или неинфекционными факторами. При правильном лечении процесс обычно обратим.
Артерииты могут стать причиной инфаркта миокарда при следующих заболеваниях:
- сифилис;
- болезнь Такаясу;
- узелковый периартериит;
- системная красная волчанка (СКВ);
- другие ревматические заболевания.
Травмы
Приникающие ранения и открытые травмы грудной клетки часто повреждают сердечную мышцу, что может привести к гибели кардиомиоцитов и очаговому кардиосклерозу. Однако такие случаи не считаются инфарктами из-за иного механизма. При закрытых травмах может возникнуть контузия миокарда, в результате чего часть крови покидает коронарные сосуды. Через несколько дней после травмы могут возникнуть осложнения. Активация свертывающих факторов может привести к образованию тромба в сосуде (тромб in situ), что остановит кровоток и спровоцирует инфаркт.
Сложность заключается в том, что не всегда учитывается риск инфаркта после закрытых травм. Рекомендуется госпитализировать пациента до полной стабилизации состояния.
Утолщение артериальной стенки
Существует множество заболеваний, вызывающих нарушения обмена веществ, что приводит к накоплению веществ в стенках артерий. Это вызывает утолщение сосудистых стенок и ухудшение коронарного кровотока. Обычно процесс необратим и прогрессирует медленно, в отличие от воспалительных процессов. Утолщение стенок может также быть вызвано разрастанием соединительной ткани под воздействием внешних факторов.
Утолщение стенок коронарных артерий может наблюдаться при следующих заболеваниях:
- амилоидоз;
- мукополисахаридоз;
- болезнь Фабри;
- гомоцистинурия;
- ювенальный склероз интимы (с отложением кальция);
- гиперплазия из-за неправильного приема контрацептивов (у женщин);
- гиперплазия после лучевой терапии опухолей средостения.
Утолщение стенок сужает просвет сосуда, ухудшая кровоток и увеличивая риск ишемии миокарда. В условиях физической нагрузки или коронарного спазма это может привести к инфаркту. Все перечисленные заболевания встречаются редко, и инфаркт чаще является их осложнением.
Эмболия коронарных артерий
Эмболия — это закупорка артерии, вызванная оторвавшимся тромбом. Коронарные артерии получают кровь из аорты, поэтому места образования тромбов ограничены: это полость левого желудочка, левое предсердие и легочные вены. Тромбы из вен нижних конечностей или других частей тела попадают в правые отделы сердца, что может привести к эмболии легочной артерии. Однако они не могут пройти через капилляры легких в левые отделы сердца. Эмболия коронарных артерий встречается редко и чаще всего связана с сердечными заболеваниями.
К тромбоэмболии коронарных артерий могут привести:
- инфекционный эндокардит (эмболы — скопления микроорганизмов в желудочке);
- абактериальный эндокардит;
- тромбы на имплантированных клапанах и катетерах (из-за активации системы свертывания);
- папиллярная фиброэластома клапана аорты (редкое явление).
В таких случаях часто наблюдается обширный инфаркт, предынфарктный период может отсутствовать. Тромб отрывается, перемещается из аорты в коронарную артерию и блокирует кровоток в определенной области миокарда. Восстановить кровоснабжение быстро не удается, что приводит к значительному некрозу и неблагоприятному прогнозу. Симптомы развиваются стремительно, существует высокий риск серьезных осложнений в остром периоде.
Несоответствие потребностей миокарда и доставки кислорода
В некоторых случаях сердце работает интенсивнее, в то время как коронарные сосуды имеют ограничения. Это может привести к гибели кардиомиоцитов и инфаркту миокарда. Основные причины таких состояний — заболевания, при которых увеличивается частота сердечных сокращений или нагрузка на сердечную мышцу.
Повышенные потребности миокарда в кислороде могут возникать при следующих заболеваниях:
- Стеноз аорты. Сердце сокращается с большей силой, чтобы прокачать кровь через узкий участок, что увеличивает потребление энергии.
- Пороки развития аортального клапана. Аналогичный механизм, но сужение происходит на уровне клапана (например, врожденное сращение створок).
- Тиреотоксикоз. Повышенный уровень гормонов щитовидной железы (тироксин и трийодтиронин) увеличивает частоту сердечных сокращений. Это состояние может возникать при заболеваниях щитовидной железы или патологиях гипофиза.
- Длительное пониженное артериальное давление. Мозг посылает сигнал сердцу работать быстрее для повышения давления. Если этого не происходит (например, после обильных кровотечений), сердце расходует энергию, не получая ее обратно через усиленный приток артериальной крови.
Нарушения свертывания крови
В редких случаях тромбы образуются в коронарной артерии, чаще при повышенной свертываемости крови. Это может быть связано с увеличением уровня тромбоцитов (тромбоцитоз), наблюдаемым при полицитемии. Также после травм или при сепсисе может развиваться диссеминированное внутрисосудистое свертывание (ДВС), при котором тромбы формируются в различных сосудах, не только в коронарных артериях. В любом случае это приводит к сужению или полному закрытию просвета артерии, что вызывает острое нарушение кровоснабжения миокарда.
Послеоперационные осложнения
Инфаркт может возникать как осложнение после хирургических вмешательств, особенно при операциях на сердце или рядом с ним. Также возможно развитие спазма или закупорки коронарных артерий во время некоторых диагностических процедур. Не всегда можно говорить о врачебных ошибках, так как предсказать такие осложнения бывает сложно.
Инфаркт может стать осложнением следующих медицинских процедур:
- коронарное шунтирование (в области замененного сосуда может образоваться тромб);
- ушивание аневризмы сердца (если не выполняется одновременно пластика сосудов);
- установка кардиостимулятора;
- коронарография (введение катетера может спровоцировать спазм коронарных сосудов).
Для предотвращения тромбообразования назначаются препараты, разжижающие кровь. Пациенты находятся под наблюдением врачей в течение некоторого времени после процедуры.
Аномалии развития коронарных артерий
В редких случаях возникают наследственные или врожденные аномалии, влияющие на работу сердца. Генетические заболевания могут вызывать учащение сердечных сокращений, что увеличивает потребность в кислороде и нарушает передачу импульсов по миокарду. Внутриутробно может не сформироваться просвет коронарной артерии, что приводит к ишемии определенной области сердца сразу после рождения. Врожденные и наследственные патологии чаще становятся причиной инфаркта у молодых людей, в то время как у пожилых это встречается реже.
Молодежи, не страдающей ишемической болезнью сердца и стенокардией, следует обратить внимание на факторы риска. Их наличие или отсутствие помогает оценить вероятность инфаркта миокарда в будущем. Исследования показывают, что сознательное избегание некоторых из этих факторов эффективно предотвращает заболевание.
К факторам, косвенно влияющим на риск инфаркта, относятся:
- случаи инфаркта миокарда среди близких родственников;
- случаи сахарного диабета в семье;
- высокий уровень холестерина;
- курение;
- малоподвижный образ жизни;
- гипертония (повышенное артериальное давление).
Признаки и симптомы инфаркта миокарда
Основной признак инфаркта миокарда — боль за грудиной, напоминающая стенокардию, но более интенсивная. В зависимости от размеров и расположения очага, а также степени нарушения насосной функции сердца, могут возникать и другие симптомы. Клиническая картина инфаркта обычно характерна, и при классическом течении его не путают с другими заболеваниями. Однако атипичные проявления распознать сложнее, так как они могут маскироваться под другие недуги, а симптомы не всегда связаны с сердечными проблемами.
При классическом течении инфаркта миокарда наблюдаются следующие симптомы:
- боль за грудиной;
- повышенное потоотделение;
- бледность кожи;
- одышка;
- чувство страха смерти;
- потеря сознания.
Боль за грудиной
Боль — основной признак инфаркта миокарда. У этого заболевания есть особенности, помогающие в диагностике, но боль не всегда присутствует. В некоторых случаях она отсутствует (атипичное течение), что чаще наблюдается у пожилых людей и пациентов с диабетом из-за нарушений обмена веществ.
Иногда боль при инфаркте трудно отличить от стенокардии. Пациенты с атеросклерозом коронарных артерий могут привыкнуть к периодическим болям и не заметить изменений.
Сравнение болевого синдрома при стенокардии и инфаркте миокарда
| Критерий | Стенокардия | Инфаркт миокарда |
| Длительность | Приступы боли длятся 5–15 минут, между ними есть паузы. | Боль может развиваться постепенно, но не ослабевает и длится от 15 минут до нескольких часов. |
| Интенсивность | Боль усиливается, но может быть терпимой. | Боль значительно интенсивнее, чем при стенокардии, и может возникать внезапно. |
| Сопутствующие симптомы | Обычно отсутствуют, одышка встречается редко. | Холодный пот, страх смерти, ощущение проблемы с сердцем. |
| Реакция на нитроглицерин | Боль купируется через 3–5 минут. | Нитроглицерин улучшает кровоток, но боль не проходит из-за погибших клеток. |
| Локализация боли | Локализуется за грудиной, редко распространяется. | Локализуется за грудиной, может отдавать в шею или левое плечо. |
Боль постоянная, пациенты описывают её как колющую, ноющую, жгучую или сдавливающую. Последняя характеристика наиболее распространена, так как боль мешает нормальному дыханию. В зависимости от интенсивности боли пациент может проявлять волнение, но затем становится менее активным. При внезапной боли пациенты часто хватаются за грудь.
Наиболее часто боль возникает в следующих ситуациях:
- физическая нагрузка;
- сильный стресс;
- чрезмерное употребление алкоголя, никотина или наркотиков;
- переедание.
Эти факторы могут служить триггерами, и пациенты часто отмечают, что боль началась в определённых условиях.
Потоотделение
Симптом наблюдается у большинства пациентов сразу после начала болевого эпизода и является реакцией вегетативной нервной системы. Пот обильный, липкий и холодный, быстро появляется и высыхает. В редких случаях (при атипичном течении) пот может возникать без выраженного болевого синдрома.
Побледнение кожи
Побледнение кожи в начале приступа боли может быть рефлекторной реакцией. Если инфаркт обширен и функция левого желудочка нарушена, бледность сохраняется из-за сердечной недостаточности. Нормальный цвет кожи у здоровых людей зависит не только от пигментов, но и от состояния кровеносных сосудов. При расширении сосудов и их наполнении кровью появляется здоровый румянец. У пациентов с инфарктом сосуды сужаются, что происходит как реакция на боль, так и для «сохранения» крови для жизненно важных органов. В результате кожа становится бледной, а ухудшение кровообращения может вызывать холод в пальцах рук и ног.
Одышка
Одышка — это нарушение дыхательной функции, при котором пациент испытывает трудности с ритмичным и глубоким дыханием, что вызывает дискомфорт. При инфаркте миокарда одышка возникает из-за сильной боли и дисфункции левого желудочка. Кровь не поступает в аорту, что приводит к застою в левом предсердии и малом круге кровообращения. Переполнение сосудов легких затрудняет газообмен, что и вызывает одышку.
Этот симптом может сохраняться долго после острого периода инфаркта. Продолжительность зависит от восстановления сердечной функции и наличия осложнений. Например, частые аритмии или аневризма сердца могут вызывать одышку даже при образовании рубца в области инфаркта.
При серьезных нарушениях кровообращения (кардиогенный шок или разрыв сердца), которые могут возникать при инфаркте, одышка быстро переходит в непродуктивный кашель. Без срочной медицинской помощи это может привести к отеку легких. При отеке в легких накапливается жидкость, которая может выделяться в виде розовой пены при кашле и дыхании. В таких случаях бледность кожи может сменяться цианозом губ, кончика носа, ушей и пальцев.
Страх смерти
Этот симптом характерен для инфаркта миокарда, но его восприятие субъективно. Многие пациенты описывают свои ощущения во время приступа как резкую боль, а также отмечают нарушения дыхания и сердечного ритма.
Потеря сознания
Потеря сознания может возникать при резком снижении артериального давления, что связано с нарушением кровообращения и недостатком кислорода в мозге. В типичных случаях этот симптом наблюдается редко.
Симптомы на различных этапах инфаркта
| Этап инфаркта | Возможные симптомы |
| Предынфарктный | На этой стадии могут проявляться легкие предвестники, которые часто игнорируются. Однако их наличие не обязательно, и болезнь может развиваться сразу в остром виде. Возможные предвестники: цианоз губ и ногтей, нерегулярный пульс, повышенная чувствительность кожи на груди, тупые боли и дискомфорт за грудиной. |
| Острый | Главный симптом — боль. Пациент может быть возбужден или неподвижен. Возможны «замирания» сердца, холодный пот, одышка, страх смерти, учащенное сердцебиение, выраженная слабость. |
| Острая | Боль обычно утихает. На первый план выходят симптомы резорбционно-некротического синдрома из-за интоксикации продуктами распада мертвых кардиомиоцитов. Возможны одышка, головные боли, повышение температуры (37–38 градусов), пониженное артериальное давление, нарушения сердечного ритма. |
| Подострая | Боль может вернуться при новых участках ишемии, но чаще всего отсутствует. Пульс нормализуется, но пониженное артериальное давление может сохраняться. Иногда давление может вновь повыситься, если пациент страдал от гипертонии до инфаркта. |
| Постинфарктная | Возможны боли (стенокардия), если инфаркт вызван атеросклерозом. У большинства пациентов симптомы могут отсутствовать. |
Существуют и атипичные формы инфаркта миокарда, которые встречаются реже. В таких случаях симптомы связаны с другими органами и системами, а боль в груди может отсутствовать или быть менее выраженной. Атипичные формы чаще наблюдаются у пожилых людей или пациентов с хроническими заболеваниями. Для удобства диагностики симптомы объединены в синдромы.
Атипичные проявления инфаркта миокарда в остром периоде
| Название синдрома | Описание, основные симптомы и проявления | Заболевания с похожими проявлениями |
| Атипичный болевой синдром | Боль в области сердца менее выражена, а более ощутима в шее, нижней челюсти, левом ухе, горле, левой лопатке. | Невралгии, сколиоз, остеохондроз, зубная боль, отит. |
| Абдоминальная форма | Возникает при инфаркте задней стенки миокарда. Характеризуется болями в животе, межлопаточной области, вздутием, тошнотой, рвотой, отрыжкой, нарушениями пищеварения. В редких случаях может сопровождаться желудочно-кишечным кровотечением. | Язва желудка, обострение гастрита, панкреатит, холецистит. |
| Астматическая форма | Проявляется при ухудшении насосной функции сердца, когда в легких застаивается кровь. Симптомы: удушье, одышка, пенистая розовая мокрота, холодный пот, побледнение кожи. | Другие сердечные заболевания, вызывающие левожелудочковую недостаточность, приступ бронхиальной астмы. |
| Коллаптоидная форма | Возникает при быстром развитии кардиогенного шока. Симптомы связаны с резким падением артериального давления. Пациент может потерять сознание или жаловаться на потемнение в глазах, головокружение. | Шоковые состояния, вызванные другими причинами. |
| Отечная форма | Наблюдается при тотальной сердечной недостаточности. Симптомы: одышка, головокружение, слабость, отеки в области голеней или поясницы. В тяжелых случаях может развиться асцит. | Легочное сердце, нарушения ритма, пневмосклероз, нарушения работы клапанов. |
| Аритмическая форма | Нарушения ритма — распространенный симптом. Об атипичной форме говорят, если аритмия становится основным проявлением инфаркта, а другие признаки отсутствуют. | Пароксизмальная тахикардия и другие расстройства ритма. |
| Церебральная форма | Характерна для пожилых людей с проблемами кровообращения в сосудах мозга. Первые признаки: головокружение, шум в ушах, потемнение в глазах, обморок, тошнота, слабость. | Тромбоэмболия церебральных артерий, инсульт. |
| Стертая форма | Характеризуется отсутствием ярко выраженных симптомов. Боль в груди ощущается как дискомфорт, слабость быстро проходит, усиленное потоотделение не вызывает беспокойства. | Может восприниматься как отсутствие патологии. Диагноз подтверждается только с помощью ЭКГ или других методов. |
Инфаркт миокарда имеет разнообразные проявления. Диагноз не ставится только на основании осмотра или жалоб пациента. При появлении вышеописанных симптомов необходимо обратиться к врачу или вызвать скорую помощь для уточнения диагноза.
Виды инфаркта миокарда
Инфаркт миокарда — одна из наиболее изученных сердечных патологий. На протяжении многих лет эксперты разрабатывали классификации этого заболевания для упрощения работы медицинских работников. В настоящее время общепризнанным является деление по нескольким критериям с научным и практическим обоснованием.
Наиболее часто используется классификация инфарктов по следующим параметрам:
- размер некроза;
- стадия заболевания;
- место расположения некроза;
- наличие осложнений;
- клиническое течение.
Классификация по площади некроза
В этой классификации учитываются площадь поражения сердечной мышцы и глубина некроза, которые можно определить с помощью электрокардиографического исследования. Это позволяет сопоставить типы инфаркта с классификацией по ЭКГ. Практическое значение деления заключается в возможности оценки прогноза для пациента.
В зависимости от площади и глубины некроза выделяют следующие виды инфаркта миокарда:
- Крупноочаговый трансмуральный. Характеризуется гибелью значительного количества кардиомиоцитов. Термин «трансмуральный» указывает на поражение всей толщины миокарда (от эндокарда до эпикарда) или большей его части. На ЭКГ проявляется изменениями зубцов Q и S, поэтому его также называют инфарктом с патологическим зубцом QS. Пациенты находятся в критическом состоянии с высоким риском осложнений и летального исхода.
- Крупноочаговый нетрансмуральный. Здесь также наблюдается гибель значительного участка сердечной мышцы, но очаг не проникает насквозь. Прогноз для пациента более благоприятный, хотя уровень смертности и риск осложнений остаются высокими. На ЭКГ появляется патологический зубец Q.
- Мелкоочаговый субэндокардиальный. Образуется небольшой очаг под эпикардом, в нижних слоях миокарда. Этот вид менее опасен, так как сократительная функция частично поддерживается более поверхностными мышечными волокнами, что снижает риск осложнений. В редких случаях субэндокардиальные зоны некроза могут быть большими и классифицируются как крупноочаговый инфаркт. На ЭКГ патологического изменения зубца Q обычно не наблюдается.
- Мелкоочаговый интрамуральный. Интрамуральные очаги располагаются в толще миокарда и не соприкасаются с эндокардом или эпикардом. Эти зоны, как правило, небольшие, и их классифицируют как мелкоочаговый инфаркт. Риск для пациента минимален, хотя вероятность неблагоприятного исхода существует. На ЭКГ интрамуральный инфаркт не вызывает формирования патологического зубца Q.
Размеры и локализация очага зависят от диаметра коронарной артерии, по которой не поступает кровь.
Классификация по стадии процесса
В процессе инфаркта миокарда выделяют несколько стадий, каждая из которых характеризуется определенными процессами в сердечной мышце. Это деление важно для выбора подходов к лечению, так как на каждом этапе возникают свои осложнения и проявления заболевания, что способствует более точной диагностике.
Стадии инфаркта:
-
Предынфарктный (продромальный). Эта стадия часто определяется уже после инфаркта. Симптомы схожи с нестабильной стенокардией: боли за грудиной становятся интенсивнее и частее или возникают впервые. Ухудшение кровоснабжения сердечной мышцы может привести к некрозу. Длительность этого периода варьируется от нескольких часов до нескольких дней, и его определение затруднено, поэтому многие специалисты считают его условным.
-
Острейший. Охватывает первые 2 часа с начала приступа, когда формируется очаг некроза. Этот этап часто вызывается провоцирующими факторами, а основным проявлением является болевой синдром.
-
Острый. Период от 2 часов до 7-14 дней после приступа. В это время окончательно формируется очаг с погибшими кардиомиоцитами, происходит размягчение пораженной области. Всасывание некротических масс в кровоток вызывает резорбционно-некротический синдром, важный для диагностики. Боль может сохраняться при неправильном лечении и увеличении очага некроза.
-
Подострый. На месте погибших клеток образуется грануляционная ткань, которая затем превращается в соединительную (рубцовую). Длительность этого этапа зависит от восстановления и составляет 6-8 недель. В этот срок формируется соединительнотканный рубец, что снижает риск серьезных осложнений, которые чаще всего возникают на острейшей или острой стадии. При обследовании многие показатели нормализуются, в том числе исчезают признаки резорбционно-некротического синдрома.
-
Постинфарктный. Иногда называется периодом постинфарктного кардиосклероза, когда очаг некроза заменяется прочной соединительной тканью. Этот период продолжается до конца жизни, делится на ранний (до полугода) и отдаленный (более полугода). У большинства пациентов симптомы исчезают, но у некоторых могут вновь возникать приступы стенокардии. Наиболее распространенным осложнением является хроническая сердечная недостаточность.
Каждый период имеет свои особенности на ЭКГ, что позволяет быстро определить стадию и выбрать правильную тактику лечения.
Классификация по локализации зоны некроза
Значение локализации инфаркта в сердечной мышце велико. Это влияет на распространение электрических импульсов по миокарду и помогает прогнозировать осложнения. Например, инфаркт передней стенки левого желудочка или верхушки сердца связан с высоким риском аневризмы. Точное местоположение зоны некроза можно определить с помощью ЭКГ, а затем уточнить другими методами.
Чаще всего инфаркт миокарда затрагивает левый желудочек. Инфаркт правого желудочка встречается реже и может быть вызван легочным сердцем, что увеличивает мышечную массу и потребность в кислороде. Инфаркт предсердий встречается крайне редко.
В стенках левого желудочка зона некроза может находиться в следующих местах:
- передний – на передней стенке сердца;
- переднеперегородочный (или переднесептальный) – на передней стенке с вовлечением перегородки;
- перегородочный (септальный) – изолированный участок в межжелудочковой перегородке;
- верхушечный – в области верхушки сердца;
- передневерхушечный – крупный участок на передней стенке с переходом на верхушку;
- переднебоковой – участок, переходящий с передней стенки на левую;
- переднебазальный – участок в верхней части передней стенки, ближе к предсердию;
- распространенный передний – с вовлечением передней и боковой стенки, а также межжелудочковой перегородки;
- боковой – изолированный участок в левой стенке;
- заднедиафрагмальный – участок в нижней части задней стенки, прилегающей к диафрагме;
- заднебоковой – участок, переходящий с задней стенки на левую часть сердца;
- заднебазальный – участок высоко на задней стенке, ближе к предсердиям;
- задний – изолированный участок примерно в середине задней стенки;
- распространенный задний – с вовлечением всей задней стенки.
Точное определение места некроза не всегда обязательно. На основании ЭКГ можно указать предполагаемую область, если нет возможности предоставить точные данные. Наиболее информативным методом считается сцинтиграфия миокарда.
Классификация по наличию осложнений
В зависимости от критерия выделяют осложненный и неосложненный инфаркт миокарда. При неосложненном инфаркте состояние пациента постепенно улучшается. На месте некроза сердечной мышцы образуется прочный рубец из соединительной ткани, который незначительно влияет на работу сердца. Однако на определенных этапах могут возникать осложнения, способные ухудшить состояние пациента и даже привести к летальному исходу, несмотря на успешное восстановление до их появления.
Список возможных осложнений инфаркта миокарда с описанием представлен в соответствующем разделе.
Классификация по клиническому течению
Данная классификация включает критерии, отражающие особенности заболевания у пациента, такие как типичное и атипичное течение. Типичное течение характеризуется ангинозными болями и основными симптомами, описанными в соответствующем разделе. Атипичное течение проявляется менее выраженным болевым синдромом или симптомами, напоминающими другие заболевания.
Выделяют несколько вариантов течения болезни. Один из них — затяжное течение, при котором новые очаги некроза или расширение существующих появляются в течение 2-3 дней после начала приступа. Это затягивает острый период заболевания, увеличивая риск осложнений и ухудшая прогноз. Затяжное течение диагностируется с помощью ЭКГ, где картина острого инфаркта постепенно проявляется в новых отведениях.
Другой вариант — повторный инфаркт миокарда (или рецидивирующий инфаркт). Это новый инфаркт, возникающий после завершения острой фазы, в промежутке от 3 дней до 8 недель после первого приступа. Некоторые эксперты считают повторным инфарктом лишь тот, который произошел после полного рубцевания первого очага (не ранее чем через 2 месяца). Очаги, возникающие до этого срока, классифицируются как рецидивирующее течение. На данный момент нет единого мнения по этой классификации.
Диагностика инфаркта миокарда
Диагностика инфаркта миокарда — сложная задача. Быстрое установление предварительного диагноза критически важно для эффективной помощи. При атипичном течении заболевания инфаркт может быть ошибочно принят за другие болезни. Окончательное подтверждение диагноза и его классификация возможны лишь после госпитализации и полного обследования. Многие методы диагностики направлены не только на выявление инфаркта, но и на оценку функций сердца и раннее выявление осложнений, что позволяет своевременно начать лечение и составить точный прогноз.
Методы обследования при диагностике инфаркта миокарда:
- физикальное обследование;
- электрокардиография (ЭКГ);
- эхокардиография (ЭхоКГ);
- сцинтиграфия миокарда;
- коронарография;
- магнитно-резонансная томография (МРТ);
- анализ биохимических маркеров некроза.
Физикальное обследование
Физикальное обследование включает методы, которые врач применяет без дополнительных инструментов и требует определенных навыков. Опытный специалист может установить предварительный диагноз на основе результатов обследования, что позволяет начать лечение до госпитализации. Однако для подтверждения диагноза необходимы более объективные методы.
Физикальное обследование состоит из четырех основных методов:
- Осмотр и сбор анамнеза. Важно получить полную информацию о течении заболевания. Уточняется время появления и характер болей за грудиной, а также факторы, провоцирующие приступы (например, физическая нагрузка или стресс). Данные должны соответствовать симптомам болезни. Особое внимание уделяется характеру болевого синдрома.
- Пальпация. Этот метод включает прощупывание тканей. При инфаркте миокарда необходимо обнаружить верхушечный толчок — точку сердца, расположенную в пятом межреберье слева по средней ключичной линии. Площадь верхушечного толчка составляет 2–4 см². Смещение этой точки при инфаркте встречается редко, но возможно при осложнениях (например, аневризме сердца). Пальпация также позволяет прощупать лимфоузлы, указывающие на воспалительный процесс. Частота и наполненность пульса также определяются; при инфаркте пульс может быть ослабленным или отсутствовать. Проверяют пульс на запястьях и, при подозрении на тромбоэмболию, на бедренной артерии, в подколенной ямке и за лодыжкой.
- Перкуссия. Этот метод основан на простукивании грудной клетки для определения границ сердца. Специфических изменений при инфаркте миокарда перкуссия обычно не выявляет. При нарушении насосной функции и застое крови может произойти расширение левого желудочка, что приведет к смещению границы сердца влево. Это также может свидетельствовать о ряде осложнений (например, перикардите или аневризме сердца).
- Аускультация. Аускультация проводится с помощью стетофонендоскопа для выявления патологических тонов и шумов сердца. Первый тон сердца при инфаркте обычно ослаблен, особенно если затрагиваются папиллярные мышцы митрального клапана. Характерен систолический шум в области верхушки сердца. Появление третьего и четвертого тонов указывает на левожелудочковую недостаточность. На 3–4 день после приступа может быть слышен шум трения перикарда, который исчезает в подостром периоде при отсутствии осложнений.
Во время обследования врач также измеряет артериальное давление (обычно пониженное) и температуру. Температура может повышаться в остром периоде в рамках резорбционно-некротического синдрома, а падение давления связано с нарушением насосной функции сердца.
Электрокардиография
Электрокардиограмма (ЭКГ) — один из наиболее распространенных методов диагностики инфаркта миокарда. Исследование основано на создании электромагнитного поля с помощью электродов, размещенных на теле пациента. Электрокардиограф активирует электроды и фиксирует распространение волны возбуждения по сердечной мышце. Разные комбинации отведений позволяют точно определить характер и локализацию поражения миокарда.
Преимущества ЭКГ включают доступную стоимость, портативность (исследование можно провести на дому) и скорость получения результатов (10-15 минут). Процедура безболезненна и безопасна. По результатам ЭКГ можно быстро установить, произошел ли приступ стенокардии или инфаркт миокарда. Показатели варьируются на разных этапах патологического процесса и при осложнениях, что имеет диагностическое значение.
ЭКГ обычно снимается в 12 отведениях, отображающих электрические импульсы в различных отделах сердца:
- I отведение – передняя или боковая стенка;
- II отведение – изменения в передней и задней стенке;
- III отведение – область задней стенки, прилегающей к диафрагме;
- aVL – боковая стенка;
- aVF – задняя стенка (включая диафрагмальную поверхность);
- aVR – отражает кровоток по левой коронарной артерии;
- V1, V2 – мышечные волокна межжелудочковой перегородки;
- V3 – передняя стенка (миокард левого желудочка);
- V4 – область верхушки сердца;
- V5, V6 – боковая стенка левого желудочка.
Изменения в отведениях и анализ волн позволяют определить, какие отделы миокарда пострадали. Результаты ЭКГ также помогают оценить частоту сердечных сокращений, ритмичность и наличие экстрасистол или блокад. Это позволяет начать лечение сразу после ЭКГ.
Основные признаки инфаркта миокарда на ЭКГ на различных стадиях
| Стадия инфаркта | Описание ЭКГ |
| Предынфарктный период | Снижение сегмента ST более чем на 1 мм ниже изолинии (реже смещение вверх). Появление отрицательного зубца Т. Патологический зубец Q отсутствует. |
| Острейшая стадия | В первые 15-20 минут, в ишемической фазе, некроза клеток нет. Ишемия увеличивает амплитуду и заостряет зубец Т. Расширение зоны ишемии характеризуется смещением интервала ST вниз. При увеличении зоны некроза сегмент ST поднимается, образуя куполообразное выпячивание, иногда сливаясь с зубцом Т. После формирования зоны некроза может появиться патологический зубец Q или QS. |
| Острая стадия | Зона некроза сформирована, основным признаком является наличие патологического зубца Q или QS. Амплитуда зубца R уменьшается, сегмент ST остается куполообразно поднятым. Если некроз под эндокардом, зубец Q не формируется. Различают Q-инфаркт (трансмуральный) и не Q-инфаркт (субэндокардиальный). |
| Подострая стадия | Сохраняется патологический зубец Q или QS. Сегмент ST возвращается на уровень изолинии. Зубец Т обычно отрицательный, но его глубина уменьшается. Завершение подострой стадии определяется стабильной амплитудой зубца Т. |
| Постинфарктный период | ЭКГ отражает очаговый кардиосклероз. Регистрируется зубец Q или QS, сохраняющийся на протяжении жизни. Сегмент ST на изолинии, амплитуда зубца T не изменяется. Уменьшение зубца Q может указывать на формирование новых сосудов и гипертрофию миокарда вокруг зоны некроза. Углубление зубца T свидетельствует о сохраняющейся ишемии миокарда. |
Патологический зубец Q — основной критерий для диагноза по ЭКГ. Он считается патологическим, если ширина превышает 0,04 с (по некоторым данным 0,03 с), а амплитуда более 25% от амплитуды соседнего зубца R в том же отведении. Существуют и другие критерии для распознавания патологического зубца Q.
Эхокардиография
Эхокардиография (ЭхоКГ) — метод визуализации сердца, использующий отраженные ультразвуковые волны. Врач получает изображение в реальном времени, что позволяет быстро оценить состояние сердечно-сосудистой системы. Процедура безопасна и безболезненна, не имеет строгих противопоказаний. Длительность исследования составляет 15-20 минут, но может варьироваться в зависимости от целей диагностики.
При инфаркте миокарда ЭхоКГ предоставляет следующую информацию:
- локальные нарушения в работе миокарда (некротизированные участки не сокращаются в привычном ритме);
- в режиме допплера анализируется скорость кровотока и фракция выброса (важно для диагностики сердечной недостаточности);
- выявление тромбов;
- определение аневризмы сердца (форма, размеры и толщина стенок);
- обнаружение признаков перикардита;
- оценка функционирования сердечных клапанов;
- анализ состояния крупных сосудов;
- выявление расширения полостей сердца и других структурных аномалий.
ЭхоКГ является обязательным исследованием при инфаркте миокарда. Обычно его назначают повторно во время профилактических визитов к кардиологу в постинфарктный период для мониторинга состояния.
Сцинтиграфия миокарда
Сцинтиграфия, или радионуклидное исследование миокарда, — это информативный метод диагностики. Он основан на введении радиоактивных изотопов, которые накапливаются в определенных тканях. Для диагностики наиболее важны изотопы 99mTc-пирофосфат и 201Tl. Первый изотоп накапливается в мертвых клетках миокарда, и его можно обнаружить на изображении, если масса некротизированной ткани превышает 3 грамма, что соответствует обширному инфаркту. Исследование с технецием рекомендуется проводить через 24-48 часов после приступа. Более слабое накопление можно зафиксировать в течение 1-2 недель. Однако на снимке будут видны все участки некроза, включая те, что возникли при кардиомиопатиях, опухолях и других заболеваниях.
Сцинтиграфия с таллием (201Tl) выполняет другую функцию. Этот изотоп накапливается в хорошо кровоснабжаемых областях, отображая жизнеспособный миокард, в то время как зоны некроза не «подсвечиваются». Наиболее информативным это исследование является в первые 6 часов после приступа, но часто его не удается провести в этот срок. Важен нагрузочный тест с таллием, когда пациент выполняет физическую нагрузку после введения изотопа, а врачи наблюдают за изменениями в кровоснабжении миокарда. Эти данные важны для прогнозирования повторных инфарктов.
Оба типа сцинтиграфии применяются, когда возникают трудности с интерпретацией ЭКГ, например, при повторном инфаркте миокарда, когда результаты могут быть неясными из-за старых рубцов.
Коронарография
Коронарография — это диагностический метод для анализа кровотока в коронарных артериях. Процедура включает введение катетера через бедренную артерию и ввод контрастного вещества в коронарные сосуды. Контраст равномерно распределяется, после чего выполняется рентгеновский снимок, на котором видна сосудистая сеть сердца. Метод позволяет выявить атеросклеротические бляшки и места тромбозов, так как контраст не достигает участков с отсутствием кровотока.
Показания для коронарографии:
- планирование хирургического вмешательства на коронарных сосудах;
- кардиогенный шок;
- приступы стенокардии в ранний период после инфаркта (для возможного хирургического восстановления кровотока);
- тяжелая сердечная недостаточность или пороки клапанов (при возможности хирургической коррекции).
Не всем пациентам назначают это исследование из-за высокой стоимости и необходимости использования специальных реактивов и оборудования. Врачи также учитывают риск осложнений, что делает коронарографию более целесообразной для тяжелых пациентов. Для остальных она может представлять неоправданный риск.
Возможные осложнения коронарографии:
- кровотечение в месте доступа (обычно в бедренной артерии);
- риск инфицирования;
- провокация аритмии;
- аллергические реакции (при непереносимости компонентов контраста);
- отслоение интимы артерии с перекрытием просвета.
Магнитно-резонансная томография
Этот метод диагностики затратен и редко используется для выявления инфаркта миокарда. Он основан на регистрации движений атомов водорода в магнитном поле. При инфаркте структура мертвых участков и рубцовой ткани отличается от здоровой сердечной мышцы. Магнитно-резонансная томография (МРТ) позволяет обнаружить даже незначительные повреждения, четко визуализируя все слои сердечной стенки и точно определяя местоположение очага. МРТ также с высокой точностью оценивает форму аневризм и другие структурные аномалии.
В специальных режимах исследование используется для обнаружения тромбов и анализа структуры коронарных сосудов. Главный недостаток МРТ — необходимость в специализированном оборудовании, что значительно увеличивает стоимость исследования. Аналогичные данные, хоть и менее точные, можно получить с помощью более доступных и быстрых методов. Основное показание к проведению МРТ — невозможность точной интерпретации результатов электрокардиограммы (ЭКГ) и эхокардиографии (ЭхоКГ).
Определение биохимических маркеров некроза
При инфаркте миокарда разрушаются кардиомиоциты, что приводит к некрозу клеток. Их компоненты и ферменты попадают в кровь, что называется резорбционно-некротическим синдромом. Вещества, которые обычно отсутствуют в крови, но появляются после инфаркта, называются маркерами воспаления или некроза миокарда. Каждый маркер начинает повышаться в определённый срок после повреждения сердечной мышцы. Наиболее точные результаты достигаются при динамическом наблюдении, то есть при последовательном анализе нескольких маркеров.
Диагностические критерии инфаркта при определении основных маркеров некроза
| Биохимический маркер | Время появления маркера в крови (от момента некроза) | Определение максимальных величин | Нормальные показатели |
| Тропонин-Т | С 3 – 4 часов до 2 недель | Через 12 – 72 часа | Менее 0,1 нг/мл |
| Тропонин-I | С 4 – 6 часов до 10 дней | Примерно через сутки | Менее 0,5 нг/мл |
| Миоглобин | С 2 – 3 часов до 1 – 2 дней | Через 6 – 10 часов | 50 – 85 нг/мл |
| Креатинфосфокиназа (КФК) | С 3 – 8 часов до 3 – 6 дней | Через 24 – 36 часов | 10 – 195 МЕ/л |
| Лактатдегидрогеназа (ЛДГ) | С 8 – 10 часов до 10 – 12 дней | Через 1 – 3 дня | 240 – 480 МЕ/л (при определении оптическим тестом) |
| Аспартатаминотрансфераза (АСТ) | С 6 – 8 часов до 5 – 6 дней | Через 1 – 2 дня | Менее 34 – 41 МЕ |
Иногда биохимические маркеры некроза могут повышаться и при отсутствии инфаркта миокарда. В таких случаях необходимо искать другие заболевания, которые могут повлиять на результаты анализов. После подтверждения другого диагноза пациенту назначается соответствующее лечение.
Кроме инфаркта, причиной повышения биохимических маркеров (особенно тропонинов) могут быть:
- острые или хронические нарушения функции почек;
- гипертонический криз;
- тяжелая сердечная недостаточность с застойными явлениями;
- миокардит различной этиологии;
- травмы сердца;
- некоторые медицинские процедуры (электростимуляция, биопсия миокарда);
- ожоги, охватывающие более 30% поверхности кожи;
- инфильтративные заболевания (саркоидоз, амилоидоз, гемохроматоз).
Общий и биохимический анализ крови
Результаты общего и биохимического анализа крови могут изменяться при резорбционно-некротическом синдроме. Обычно наблюдаются умеренный лейкоцитоз и повышение скорости оседания эритроцитов (СОЭ), характерные для острейшей стадии. Если изменения продолжаются, следует рассмотреть другие причины. При тромбе, вызывающем нарушение коронарного кровообращения, могут изменяться показатели эритроцитов и параметры свертываемости крови.
Методы обследования важны для точного диагноза инфаркта миокарда. На начальных этапах врачу необходимо определить, является ли это инфарктом или другим заболеванием, так как симптомы могут напоминать патологии других органов. Этап исключения других диагнозов называется дифференциальной диагностикой.
Дифференциальная диагностика инфаркта миокарда
| Заболевание, которое необходимо дифференцировать с инфарктом миокарда | Основные отличия данной патологии от инфаркта миокарда |
| Тромбоэмболия легочной артерии (ТЭЛА) | Часто возникает после серьезных травм, сопровождающихся повреждением сосудов. Чаще у людей с венозным тромбозом. Побледнение и посинение кожи заметны в верхней части туловища. При кашле может выделяться кровь. При аускультации слышен шум трения плевры, на рентгенограмме — просветление легочного поля. |
| Расслаивающая аневризма аорты | Боль возникает внезапно, может иррадиировать и «спускаться» вниз по туловищу. Сохраняется даже после наркотических обезболивающих. Пульс на руках часто отсутствует. |
| Перикардит | При остром перикардите боль менее интенсивна, усиливается при глубоком вдохе или смене положения. При аускультации слышен шум трения перикарда. На ЭКГ может наблюдаться смещение сегмента ST, но зубец Q не формируется. |
| Спонтанный пневмоторакс | Боль возникает внезапно, быстро развивается одышка и цианоз. На стороне пневмоторакса грудная клетка не участвует в дыхании. При аускультации дыхательные шумы отсутствуют. На рентгенограмме легочный рисунок не виден. |
| Панкреатит | Острый панкреатит может быть вызван жирной пищей или алкоголем. Часто сопровождается рвотой, боль опоясывающая, локализуется в эпигастрии. При пальпации боли усиливаются. Уровень альфа-амилазы в крови и моче повышен. |
| Перфорация язвы желудка | Боль локализована в эпигастрии, появляется мгновенно. Между печенью и диафрагмой может скапливаться воздух. При пальпации определяется «доскообразный» живот. |
Таким образом, диагностика инфаркта миокарда может быть сложной задачей даже для опытных специалистов. Заподозрить заболевание можно по первым симптомам (боль в груди), но подтверждение диагноза и начало лечения возможно только после инструментальных методов и лабораторных анализов.
Оказание первой медицинской помощи при инфаркте миокарда на месте
При инфаркте миокарда важно начать лечение как можно скорее. Всемирная Организация Здравоохранения (ВОЗ) разработала рекомендации по первой помощи до приезда скорой. Пациент или находящиеся рядом люди могут значительно повысить шансы на успешное лечение, следуя этим рекомендациям.
Смертность при инфаркте зависит от площади повреждения миокарда. Чем дольше кровь не поступает к клеткам, тем выше риск летального исхода или серьезных осложнений. Поэтому с первых минут приступа необходимо облегчить нагрузку на сердце и восстановить кровоток.
Ключевые действия на догоспитальном этапе:
- Правильное положение пациента. Полусидячее положение с немного согнутыми коленями улучшает кровообращение, снижает нагрузку на сердце и предотвращает увеличение зоны некроза.
- Облегчение дыхания. При боли у пациента может возникать затрудненное дыхание. Следует расстегнуть воротник и снять галстук для улучшения поступления кислорода.
- Прием нитроглицерина. У многих людей с сердечными проблемами есть нитроглицерин – препарат, улучшающий кровообращение. Таблетку нужно положить под язык для быстрого эффекта. Рекомендуемая доза – 0,5 мг, повторить дважды с интервалом в 5 минут (максимум 1,5 мг). Врачи скорой должны быть уведомлены о приеме. При систолическом давлении ниже 90 мм рт. ст. применение не рекомендуется.
- Прием аспирина. Аспирин препятствует слипанию тромбоцитов и разжижает кровь, улучшая ее поступление к сердечной мышце. Лучше всего аспирин разжевать. Оптимальная доза – 300 мг, но следует учитывать, что пациент мог принять его ранее. Некоторые специалисты допускают применение аспирина даже при аллергии, но это может вызвать осложнения.
- Транспортировка пациента. Идеально, если пациента доставит бригада скорой помощи с необходимым оборудованием. Если это невозможно, следует самостоятельно доставить пациента в больницу, избегая резких движений и поддерживая полусидячее положение. Быстрая госпитализация критически важна для восстановления кровотока. Садиться за руль не рекомендуется из-за риска потери сознания.
- Сердечно-легочная реанимация. Реанимацию начинают при отсутствии сознания, пульса или дыхания. Она включает непрямой массаж сердца и искусственную вентиляцию легких. Непрямой массаж – ритмичные нажатия на грудную клетку. Искусственная вентиляция выполняется методом «рот в рот». Идеально, если реанимацию проводят два человека, которые меняются. Поддерживать жизнедеятельность нужно до прибытия скорой помощи.
- Использование портативного дефибриллятора. Портативные дефибрилляторы устанавливаются в местах с большим скоплением людей. При оказании первой помощи стоит узнать о наличии такого аппарата, который может помочь при остановке сердца. Применение дефибриллятора не отменяет реанимацию, короткая пауза делается только в момент разряда.
Эти меры необходимо применять в первые минуты после начала приступа. Скорая помощь должна быть вызвана через 3-5 минут, если боль за грудиной не утихает. Если у пациента была стенокардия и нитроглицерин помог, это может не быть инфарктом. Однако инфаркт может возникнуть как результат приступа стенокардии. Чтобы снизить риск летального исхода, помощь следует вызывать, несмотря на протесты пациента.
Лечение инфаркта миокарда
Лечение инфаркта миокарда проводится только в стационаре, так как это заболевание угрожает жизни пациента. Быстрая доставка в медицинское учреждение критически важна. Транспортировку осуществляет кардиологическая бригада скорой помощи. Госпитализация основана на результатах ЭКГ или явных нарушениях работы сердца. После лечения пациент проходит длительную реабилитацию дома, с возможностью санаторно-курортного лечения. Необходимы регулярные визиты к кардиологу для контроля состояния сердца и выявления осложнений.
Лечение должно сосредоточиться на основных процессах, вызвавших инфаркт. Чем быстрее врачи решат возникшие проблемы, тем лучше прогноз для пациента.
Основные задачи при лечении инфаркта миокарда:
- Восстановление кровотока в коронарных артериях. Инфаркт часто возникает из-за спазма или закупорки артерий. Быстрое восстановление кровоснабжения снижает гибель кардиомиоцитов и увеличивает шансы на выживание.
- Ограничение зоны инфаркта. Мелкоочаговый инфаркт менее опасен. Лечение направлено на защиту здоровых клеток и сужение пораженной области. Ошибки могут привести к крупноочаговому инфаркту с высокой смертностью и серьезными осложнениями.
- Обезболивание. Сильная боль может вызвать остановку сердца.
- Профилактика осложнений. Инфаркт может вызвать серьезные осложнения, которые можно предотвратить при своевременном лечении.
Методы лечения инфаркта миокарда делятся на две группы. Первая включает лекарства, назначаемые на ранних стадиях заболевания для устранения симптомов и предотвращения повреждения миокарда. Вторая группа препаратов назначается после острого периода для минимизации риска осложнений.
На ранней стадии инфаркта миокарда применяются следующие медикаменты:
- анальгетики;
- транквилизаторы;
- тромболитическая терапия;
- антиагреганты;
- антикоагулянты;
- бета-адреноблокаторы;
- нитраты;
- ингибиторы АПФ.
Анальгетики
Обезболивающие средства чаще всего применяются врачами скорой помощи и медицинским персоналом в стационаре. При инфаркте миокарда, где боль может быть интенсивной, используются наркотические анальгетики из группы опиоидов.
Для облегчения боли применяются следующие препараты:
- Морфин. Вводится медленно и внутривенно. Начальная доза — 4–8 мг. Если боль не устраняется, можно ввести еще 2 мг через 5–10 минут, повторив эту дозу один раз. Перед введением морфин разводят в 0,9% растворе NaCl: на 10 мг препарата требуется 10 мл раствора.
- Фентанил. Вводится внутривенно, стандартная доза — 0,05–0,1 мг.
- Дроперидол. Не является чистым анальгетиком, используется с наркотическими анальгетиками для нейролептанальгезии. Вводится внутривенно, медленно, в дозе 5–10 мг, подбирается индивидуально в зависимости от уровня артериального давления (чем выше давление, тем больше доза).
Сильные анальгетики эффективно снимают болевой синдром за 3–5 минут. При необходимости в стационаре их можно применять повторно. Нейролептанальгезия помогает не только устранить боль, но и облегчить симптомы, такие как возбуждение, тревога и страх смерти.
Транквилизаторы
Используются редко и только в критических ситуациях. Эти лекарства необходимы для устранения психомоторного возбуждения у пациента (при болевом синдроме или сопутствующих нарушениях). В таких случаях предпочтителен диазепам, который вводят внутривенно в дозировке 5–10 мг.
Тромболитическая терапия
Тромболитическая терапия — это метод лечения, направленный на растворение тромба в коронарной артерии и восстановление кровообращения. Хотя она не восстанавливает погибшие кардиомиоциты, терапия предотвращает расширение зоны некроза, что снижает риск осложнений и улучшает прогноз пациента.
Основное показание для начала тромболитической терапии — подъем сегмента ST на электрокардиограмме. Препараты следует вводить как можно быстрее, максимальный эффект достигается в течение первого часа после начала приступа. На практике более реалистичный временной лимит — три часа.
Наиболее эффективные препараты для тромболитической терапии
| Название препарата | Рекомендуемая доза | Особые указания |
| Алтеплаза | 100 мг | Вводится внутривенно (в/в): первые 15 мг сразу, затем 50 мг в течение получаса и 35 мг в течение часа. |
| Стрептокиназа | 1,5 млн. ЕД | Вводится в/в постепенно в течение часа. |
| Проурокиназа | 80 мг | Вводится в/в: первые 20 мг сразу, затем 60 мг капельно в течение часа. |
| Ретеплаза | 20 ЕД | Вводится в/в двумя дозами по 10 ЕД с перерывом в полчаса. |
| Тенектеплаза | 0,5 мг на 1 кг веса пациента | Вводится в/в в течение 5–10 секунд. |
Все препараты могут вызывать побочные эффекты, включая повышенный риск спонтанных кровотечений. Существуют противопоказания, исключающие применение тромболитической терапии для некоторых пациентов. В таких случаях необходимо использовать альтернативные методы лечения.
Тромболитическую терапию нельзя применять при следующих состояниях:
- геморрагический инсульт в анамнезе;
- ишемический инсульт за последние шесть месяцев;
- послеоперационный период (в течение месяца после хирургического вмешательства);
- наличие злокачественных опухолей;
- недавние кровотечения в желудочно-кишечном тракте (ЖКТ), например, на фоне язвы желудка;
- некоторые заболевания кроветворной системы.
Антиагреганты
Препараты этой группы влияют на клетки крови, особенно на тромбоциты, снижая их склонность к агрегации и прилипанию к стенкам сосудов. Это уменьшает риск тромбообразования. Антиагреганты также воздействуют на мембраны эритроцитов, облегчая их движение через капилляры, что ускоряет кровоток через суженные участки сосудов. Это способствует восстановлению кровоснабжения миокарда и замедляет распространение некроза.
В настоящее время предпочтение отдается ацетилсалициловой кислоте (аспирину). Начальная доза, назначаемая сразу после приступа (в острейшей стадии инфаркта), составляет 160-325 мг. Препарат принимается в форме таблеток, которые рекомендуется разжевывать для быстрого эффекта. В дальнейшем аспирин или его аналоги назначаются в дозе 15-160 мг один раз в день. Длительность курса лечения определяет врач в зависимости от состояния пациента. Статистические данные показывают, что применение аспирина в остром и подостром периодах инфаркта снижает риск серьезных осложнений на 25-30%.
Показанием для начала терапии антиагрегантами является подъем сегмента ST на кардиограмме. Основным противопоказанием для лечения аспирином является язвенная болезнь желудка или двенадцатиперстной кишки, так как аспирин может негативно воздействовать на слизистую оболочку ЖКТ.
Антикоагулянты
Антикоагулянты могут повышать эффективность тромболитической терапии. Решение о назначении принимает врач на основе анализов. Эти препараты предотвращают образование тромбов и снижают риск тромбоэмболии в остром и подостром периодах. Однако их использование может увеличить риск побочных эффектов от тромболитической терапии, таких как кровотечения. При применении урокиназы антикоагулянты не используются.
Основные антикоагулянты для лечения инфаркта миокарда:
- нефракционированный гепарин (вначале внутривенно, затем подкожно);
- далтепарин – подкожно;
- надропарин кальция – подкожно;
- эноксапарин натрия – подкожно.
Дозировка подбирается индивидуально в зависимости от комбинации с тромболитиками и результатов лабораторных исследований, особенно показателей АЧТВ (активированное частичное тромбопластиновое время), отражающего свертываемость крови.
Бета-адреноблокаторы
Данная категория медикаментов уменьшает нагрузку на сердце и потребность миокарда в кислороде. Бета-адреноблокаторы снижают частоту и силу сердечных сокращений, что помогает предотвратить распространение некроза. Эти препараты важны на всех этапах лечения, если нет противопоказаний.
Бета-адреноблокаторы в терапии инфаркта миокарда
| Название препарата | Дозировка и режим приема |
| Атенолол | Вводится внутривенно 2,5 – 5 мг, при необходимости дважды с интервалом 10 – 15 минут. Затем переходят на пероральный прием: через 15 минут 50 мг, затем по 100 мг в сутки. Длительность курса индивидуальна. |
| Метопролол | Вводится внутривенно 2,5 – 5 мг за раз. При отсутствии побочных эффектов возможно повторное введение с интервалом 2 – 5 минут до общей дозы 15 мг (3 – 6 введений). Затем переходят на таблетки: через 15 минут 50 мг, затем в течение 2 дней по 200 мг/сут в 4 приема, далее по рекомендации врача. |
| Пропранолол | Вводится внутривенно 2 – 3 мг за раз, затем по 1 мг каждые 3 – 4 минуты. Общая доза не должна превышать 0,1 мг на 1 кг массы тела. Через 2 часа 40 мг внутрь, затем по 80 мг трижды в день в течение нескольких дней. |
Эти препараты могут снизить частоту сердечных сокращений до 50 – 60 ударов в минуту. Их не назначают при низкой частоте сердечных сокращений, низком артериальном давлении или выраженной сердечной недостаточности. На ЭКГ противопоказанием считается удлинение интервала P – Q до 0,24 с и более. Возможным побочным эффектом является сужение мелких бронхов, поэтому они не рекомендуются при астме или астматической форме инфаркта. Противопоказания могут быть временными, и после стабилизации состояния препараты могут быть включены в лечение. Обычно их начинают с малых доз, постепенно увеличивая для достижения терапевтического эффекта.
Использование бета-блокаторов после инфаркта снижает риск рецидива, аневризмы сердца и серьезных нарушений ритма. Некоторые пациенты принимают эти препараты длительное время после сердечного приступа (месяцы, годы).
Ингибиторы АПФ
Ингибиторы ангиотензинпревращающего фермента (АПФ) назначаются пациентам с сердечной недостаточностью после обширного инфаркта миокарда. Эти препараты расширяют сосуды, снижают артериальное давление и замедляют сердечный ритм. Противопоказаны при систолическом давлении ниже 100 мм рт. ст., почечной недостаточности и у беременных. Лечение начинается с короткодействующих препаратов в малых дозах (чаще каптоприл), затем при хорошей переносимости переходят на более мощные аналоги с пролонгированным действием.
В терапии инфаркта миокарда могут использоваться следующие ингибиторы АПФ:
- Каптоприл. Начальная доза 6,25 – 12,5 мг, с увеличением до 100 — 150 мг (по 50 мг 2 – 3 раза в день).
- Рамиприл. Начальная доза 1,25 – 2,5 мг, с повышением до 10 мг (дважды в день по 5 мг).
- Эналаприл. Начальная доза 2,5 мг, с увеличением до 20 мг (по 10 мг дважды в день).
- Лизиноприл. Начальная доза 2,5 – 5 мг, с повышением до 20 мг (дважды в день по 10 мг).
Многие пациенты продолжают лечение в течение месяцев или лет из-за риска осложнений или повторных инфарктов. Осложнения, такие как аневризма сердца или хроническая сердечная недостаточность, могут требовать постоянного приема определенных препаратов. Схемы лечения подбираются индивидуально лечащим врачом. Если выявлена причина инфаркта, может потребоваться дополнительное лечение (например, антибиотики при инфекциях сердца, иммуносупрессия при системных заболеваниях, гиполипидемическая терапия при атеросклерозе).
Кроме медикаментозного лечения, применяются хирургические вмешательства при наличии показаний.
Для лечения инфаркта могут использоваться следующие виды оперативных вмешательств:
- Чрескожное коронарное вмешательство. Минимально инвазивный метод восстановления кровотока в коронарных артериях. В крупный сосуд (обычно бедренную артерию) вводится зонд, который направляется к месту закупорки. Удаляется тромб, при сужении сосуда устанавливается стент — металлическая сетка, предотвращающая повторное сужение. Основное осложнение — тромбоз стента, поэтому назначаются антикоагулянты.
- Шунтирование коронарных сосудов. Сложная операция на открытом сердце с использованием аппарата искусственного кровообращения. Создается обходной путь для крови вокруг закупорки с помощью фрагмента сосуда, восстанавливающего кровоток. Операция не выполняется сразу после инфаркта, а на более поздних этапах.
- Иссечение аневризмы сердца. Применяется при образовании постинфарктных аневризм, которые могут разорваться. Рекомендуется хирургическое удаление аневризмы с укреплением поврежденного миокарда. Операция проводится после восстановления пациента.
- Установка водителей ритма. При серьезных нарушениях сердечного ритма, не поддающихся медикаментозному лечению, устанавливается специальный водитель ритма, который нормализует ритм сокращений. Существуют различные модели кардиостимуляторов для разных групп пациентов.
Эффективность лечения оценивается по результатам ЭКГ и клиническим наблюдениям. На ЭКГ наблюдается снижение сегмента ST, что свидетельствует о восстановлении кровотока в коронарных артериях. Клинические признаки успешного лечения — уменьшение или исчезновение боли, одышки и восстановление нормального сердечного ритма.
Последствия и осложнения инфаркта миокарда
Все последствия инфаркта могут угрожать жизни и здоровью пациента. Их возникновение связано с нарушениями работы сердца, проблемами с перекачиванием крови или активацией системы свертывания. Каждый этап инфаркта имеет свои специфические осложнения. Наиболее опасные состояния наблюдаются в острейшей и острой фазах. Многие пациенты умирают из-за осложнений.
Наиболее распространенные осложнения острого инфаркта миокарда:
- нарушения сердечного ритма;
- сердечная недостаточность;
- кардиогенный шок;
- острая аневризма сердца;
- разрыв сердца;
- синдром Дресслера;
- тромбоэмболические осложнения.
Нарушения ритма
Разнообразные нарушения сердечного ритма наблюдаются у 92-97% пациентов, что делает их наиболее частым осложнением инфаркта миокарда. Эти нарушения возникают из-за того, что область некроза нарушает равномерное распределение биоэлектрических импульсов по сердечной мышце. Чем больше площадь поражения, тем более выраженными становятся нарушения ритма. Все они делятся на три основные категории.
По степени угрозы для пациента выделяют следующие группы нарушений сердечного ритма:
- Не оказывающие влияния на прогноз. В эту категорию входят нарушения, связанные с выработкой импульсов синусовым узлом. Это тахикардии, брадикардии и спонтанные экстрасистолы (внеочередные сокращения миокарда). Импульсы формируются в синусовом узле и свободно распространяются по миокарду. К этой же группе относится миграция водителей ритма по предсердиям.
- Ухудшающие прогноз. В эту категорию входят выраженные тахикардии (более 110 ударов в минуту), брадикардии (менее 50 ударов в минуту) и частые желудочковые экстрасистолы. В таких случаях сокращения желудочков не обеспечивают необходимый объем крови, что увеличивает риск сердечной недостаточности. Также сюда относятся атриовентрикулярные блокады (замедление импульса в области атриовентрикулярного узла), пароксизмальные тахикардии и синдром слабости синусового узла.
- Угрожающие жизни пациента. Эти осложнения наиболее серьезны и могут привести к летальному исходу из-за резкого ухудшения работы сердца. К ним относятся пароксизмальная желудочковая тахикардия, асистолия желудочков (отсутствие их сокращений), фибрилляция и трепетание желудочков (хаотичные сокращения с высокой частотой).
Наиболее серьезные нарушения ритма возникают непосредственно после инфаркта, в остром или острейшем периоде. Важную роль играют болевой синдром, расположение зоны некроза и объем пораженной области. По мере формирования рубцовой ткани ритм сердечных сокращений стабилизируется, однако периодические приступы могут возникать на протяжении всей жизни (особенно при образовании хронических аневризм и других осложнений).
Сердечная недостаточность
Сердечная недостаточность после инфаркта миокарда может быть острой или хронической. Наибольшую опасность представляет острая недостаточность левого желудочка, развивающаяся в остром или острейшем периоде заболевания. Это состояние связано с серьезными нарушениями насосной функции сердца: левый желудочек, поврежденный инфарктом, не справляется с объемом поступающей крови.
Ключевые факторы, способствующие развитию острой сердечной недостаточности после инфаркта:
- обширная зона некроза (15–25% массы миокарда левого желудочка);
- гибель сосочковых мышц, отвечающих за работу митрального клапана (что приводит к митральной недостаточности);
- серьезные нарушения сердечного ритма;
- перфорация межжелудочковой перегородки;
- образование острого аневризмы сердца.
В результате левый желудочек теряет способность нормально сокращаться, что вызывает застой крови, или его стенки не могут растягиваться для приема крови в диастолу. Это приводит к недостаточному кровоснабжению аорты, вызывая гипоксию тканей и органов. В легких наблюдается застой жидкости, а при значительных нарушениях функции может развиться отек легких, когда жидкость проникает из капилляров в альвеолы. Без неотложной помощи это может привести к остановке дыхания.
Хроническая сердечная недостаточность обычно развивается через месяцы или годы после инфаркта. Механизм ее возникновения связан с повреждением миокарда левого желудочка, но в этом случае повреждения менее выражены, что не создает непосредственной угрозы жизни. Тем не менее, хроническая сердечная недостаточность может вызывать кашель, одышку, отеки, слабость и головокружение, что ухудшает качество жизни. Это состояние сложно лечить: в начале можно поддерживать функцию левого желудочка медикаментами, но со временем нарушения, как правило, усугубляются, увеличивая риск перехода в острую форму.
Кардиогенный шок
Кардиогенный шок — это тяжелая форма острой недостаточности левого желудочка, возникающая из-за резкого ухудшения насосной функции сердца. Обычно он развивается при инфаркте, затрагивающем 40% и более миокарда. В результате значительная часть стенки левого желудочка теряет способность сокращаться, что приводит к недостаточному объему крови в аорту. Сердце не может поддерживать нормальное артериальное давление, и организм не компенсирует эту недостаточность, что вызывает кислородное голодание жизненно важных органов.
Частота кардиогенного шока у пациентов с инфарктом зависит от качества медицинской помощи. При своевременном вмешательстве он наблюдается у 7% пациентов, а без адекватной помощи — до 20%.
Коронарный шок опасен тем, что формируется порочный круг: низкое давление в аорте уменьшает приток крови в коронарные артерии, что ухудшает работу миокарда. Сопутствующие нарушения в других органах могут быстро привести к летальному исходу.
Первые признаки кардиогенного шока включают потерю сознания, затуманивание зрения, сердцебиение и общую слабость. Кожа становится бледной с сероватым или синеватым оттенком (серый цианоз). Основным диагностическим признаком является отсутствие пульса или едва ощутимый нитевидный пульс, а также снижение систолического артериального давления ниже 90 мм рт. ст. Нарушения в работе левого желудочка могут вызвать застой крови в легких и отек легких. В этих случаях необходимы срочные реанимационные мероприятия, однако они не гарантируют спасение.
Острая аневризма сердца
Острая аневризма сердца возникает в течение первых двух недель после инфаркта миокарда. Это локализованное выпячивание стенки сердца, чаще всего на передней стенке левого желудочка или в области его верхушки. Аневризма формируется из-за снижения прочности и эластичности сердечной мышцы. Под внутренним давлением стенка сердца растягивается, образуя патологическую полость, где сокращения не происходят, что приводит к застою крови.
Опасности аневризмы сердца:
- угроза разрыва, что может вызвать серьезное кровотечение;
- нарушения ритма сердца;
- высокая вероятность сердечной недостаточности;
- образование тромбов в полости аневризмы.
Заболевание часто протекает без выраженных симптомов. Однако аневризму можно выявить во время профилактических обследований, таких как ЭКГ или ЭхоКГ. При этом осложнении инфаркта миокарда обычно требуется хирургическое вмешательство для ушивания и укрепления пораженного участка.
Разрыв сердца
Разрыв сердца — одно из серьезных осложнений инфаркта миокарда, часто приводящее к быстрой смерти пациента. Вероятность разрыва в первую неделю после инфаркта достигает 2,5%. Обычно это происходит при трансмуральных инфарктах, когда соединительная ткань не успевает укрепиться для выдерживания высокого давления.
Факторы, увеличивающие риск разрыва:
- у женщин (риск вдвое выше);
- при первом инфаркте (при повторных случаях вероятность ниже);
- высокий уровень МВ-фракции креатинфосфокиназы;
- несоблюдение режима в постинфарктный период (например, чрезмерные физические нагрузки);
- запоздалое обращение за медицинской помощью (более суток после приступа);
- прием глюкокортикоидов и нестероидных противовоспалительных препаратов (ухудшают рубцевание в области некроза).
На данный момент нет эффективного лечения разрыва, так как остановить кровотечение практически невозможно. Поэтому усилия врачей и пациентов в постинфарктный период должны быть направлены на профилактику разрыва сердца (своевременное лечение и соблюдение режима).
Синдром Дресслера
Постинфарктный аутоиммунный синдром Дресслера — редкое осложнение, наблюдаемое у менее чем 5% пациентов после инфаркта миокарда. Обычно он проявляется в остром периоде, но возможны случаи, когда симптомы возникают в начале инфаркта. Синдром включает поражение тканей, не связанных с сердечной мышцей.
Клинические проявления синдрома Дресслера:
-
Перикардит. Наиболее распространенная форма синдрома. Воспаление перикарда вызывает постоянные ноющие боли в груди, шум трения при прослушивании сердца и подъем сегмента ST на ЭКГ, который обычно нормализуется без осложнений. Течение напоминает фибринозный или экссудативный перикардит и проходит самостоятельно в течение 1-2 недель, хотя возможны и более тяжелые случаи.
-
Плеврит. Воспаление плевры может проявляться как фибринозный, так и экссудативный плеврит. В плевральной жидкости содержится много лимфоцитов и эозинофилов. Симптомы включают боли при дыхании, болезненный кашель и шум трения плевры при аускультации. Обычно плеврит хорошо поддается лечению.
-
Пневмонит. Воспаление легочной ткани встречается реже, чем плеврит или перикардит. Основной симптом — кашель с небольшим количеством отделяемого, иногда с примесью крови. Вязкая мокрота, как при инфекциях, не образуется. На рентгене выявляют очаги в нижних долях легких. Без лечения возможны инфекционные осложнения.
-
Синовит. Воспаление синовиальной оболочки суставов, при котором в полости может скапливаться избыточная жидкость. Синовит считается типичным проявлением синдрома Дресслера, в то время как изолированное поражение суставов — редкость. Симптомы включают умеренные боли и ограничение подвижности в локтевых, плечевых и лучезапястных суставах. В редких случаях может наблюдаться синдром передней грудной стенки.
-
Атипичные проявления. Эти формы не соответствуют основным проявлениям и встречаются крайне редко. К ним относятся экзема, дерматит, васкулит, гломерулонефрит и астматический синдром.
Синдром Дресслера имеет аутоиммунную природу. Повреждение органов происходит из-за реакции иммунной системы на вещества, высвобождающиеся в кровь при некрозе кардиомиоцитов. Иммунная система распознает эти вещества как чуждые и начинает вырабатывать антитела, вызывая воспалительный процесс. Часто синдром сопровождается системными изменениями: повышением температуры, увеличением уровня эозинофилов и скорости оседания эритроцитов, что указывает на воспаление. Поражение может затрагивать один или несколько органов, хотя одновременное поражение всех встречается редко.
Тромбоэмболические осложнения
Данная категория включает осложнения, возникающие из-за образования и отрыва тромба. Тромб перемещается по сосудам и может застрять в узком месте, что приводит к окклюзии. Острое нарушение кровообращения вызывает ишемию органа или анатомического отдела, получающего кровь через этот сосуд.
Причины формирования тромбов у пациентов после инфаркта:
- активация системы свертывания крови;
- образование тромба в левом желудочке рядом с зоной инфаркта из-за воспалительного процесса;
- образование тромба в полости аневризмы (если она имеется);
- застойная сердечная недостаточность;
- нарушения сердечного ритма;
- наличие атеросклеротических бляшек, ставших причиной инфаркта;
- застой крови в венах нижних конечностей, часто с развитием тромбофлебита.
Учитывая эти факторы, тромболитическая терапия стала важной частью лечения пациентов с инфарктом. Ее применение значительно снижает риск образования и отрыва тромбов, и такие осложнения наблюдаются не более чем в 4-5% случаев.
Оторвавшиеся тромбы могут привести к закупорке следующих сосудов:
- Легочная артерия. Тромбы, образовавшиеся в венах (чаще всего нижних конечностей) или в правом желудочке, могут закупорить легочную артерию, вызывая серьезные нарушения дыхания и кровообращения.
- Бифуркация брюшной аорты. Тромб застревает в нижней части аорты на уровне ее раздвоения. Это приводит к нарушению кровоснабжения нижних конечностей, исчезновению пульса на бедренной артерии и признакам шока.
- Артерии нижних конечностей. Меньший тромб может вызвать закупорку одной из артерий нижних конечностей, что приведет к исчезновению пульса только в одной ноге. Состояние менее тяжелое, но без помощи существует риск омертвения и ампутации.
- Селезеночная артерия. Тромб в артерии, питающей селезенку, вызывает резкие боли в левом подреберье из-за некроза.
- Мезентериальные артерии. Закупорка этих артерий приводит к парезу кишечника, сильным болям в животе и признакам интоксикации.
- Почечные артерии. Закупорка почечной артерии вызывает сильные односторонние боли в пояснице, резкое уменьшение мочи и повышение артериального давления.
- Мозговые (церебральные) артерии. Небольшой тромб в кровотоке мозга может привести к ишемическому инсульту, часто заканчивающемуся летальным исходом или серьезными последствиями.
Все перечисленные виды тромбозов (кроме первого) могут возникнуть в остром периоде инфаркта левого желудочка. Тромбоэмболия легочной артерии может развиваться при наличии тромбофлебита или (редко) при инфаркте правого желудочка. Во всех случаях существует серьезный риск для жизни пациента. Тромболизис должен быть выполнен как можно быстрее, чтобы предотвратить гибель тканей. Поэтому пациентам рекомендуется оставаться в больнице после инфаркта.
Для предотвращения осложнений в постинфарктный период рекомендуется соблюдать следующий режим:
- В первые 1-2 дня пациенты должны соблюдать постельный режим, чтобы исключить нагрузки, вызывающие изменения сердечного ритма или давления. В это время в месте некроза формируется рубцовая ткань.
- На 2-3 день разрешается сидеть на кровати или в кресле. Питание также можно принимать в сидячем положении.
- На 3-5 день (в зависимости от состояния) разрешается ненадолго вставать с постели и медленно перемещаться по комнате. Посещение туалета разрешено только в присутствии медицинского персонала.
- На 4-7 день разрешаются короткие прогулки по палате, этажу больницы или на улице (без лестниц). Длительность прогулки должна составлять 10-20 минут и не вызывать сильной усталости. Первые прогулки проводятся под наблюдением медицинского персонала.
- Через неделю после инфаркта, при отсутствии осложнений, пациент может самостоятельно гулять до 30 минут и принимать теплый душ. Температура воды должна быть комфортной, чтобы не вызывать нарушения дыхания или сердечного ритма.
- На вторую неделю возможна выписка пациента. Желательно начать выполнять легкие физические нагрузки в больнице, чтобы оценить реакцию организма и исключить риск повторного инфаркта или других осложнений. Например, пациент может медленно подняться по лестнице на 1-2 этажа.
Режим может быть адаптирован в зависимости от состояния пациента, наличия сопутствующих заболеваний и осложнений. Например, при нарушениях сердечного ритма реабилитация проходит медленнее. Такой постепенный режим нагрузок снижает вероятность осложнений, укрепляет соединительную ткань в некротизированной области и восстанавливает нормальную сократимость сердца.
Что делать после инфаркта миокарда?
Пациентам, перенесшим инфаркт миокарда, необходимо после выписки и на протяжении всей жизни придерживаться особого образа жизни. Это поможет избежать осложнений и повторных инфарктов. Чем строже пациент будет следовать рекомендациям, тем быстрее произойдет восстановление и тем полноценнее станет жизнь.
Ключевые правила после инфаркта:
- Исключение тяжелых физических нагрузок. Физическая активность требует увеличенного притока крови к мышцам, что приводит к более частым сокращениям сердца. После инфаркта могут оставаться слабые участки (аневризмы, постинфарктный кардиосклероз), подверженные разрыву. Также повышается риск повторного инфаркта. Длительность ограничений по физической активности определяет лечащий врач, следящий за состоянием пациента.
- Соблюдение диеты. Рекомендуется придерживаться лечебной диеты номер 6 по Певзнеру. Она способствует нормализации кровообращения, снижению артериального давления и ограничению животных жиров, содержащих холестерин — одну из причин атеросклероза и инфаркта. В постинфарктный период следует исключить алкоголь, жареное мясо, жирные бульоны, соленую и острую пищу. Рекомендуются овощи, фрукты, каши, нежирные сорта мяса и рыбы.
- Регулярные визиты к врачу. Ни одна профилактическая программа или диета не исключает риск осложнений. Для своевременного выявления проблем или оценки эффективности профилактических мер необходимо регулярно посещать кардиолога. В некоторых случаях могут потребоваться ЭКГ, ЭхоКГ, анализы крови и мочи.
Эти меры значительно улучшат качество жизни пациента, разгружая сердце и снижая вероятность нежелательных симптомов, таких как одышка, боли в груди и нарушения сердечного ритма.
Эффективность профилактических мер можно оценивать по следующим критериям:
- отсутствие симптомов сердечной недостаточности или стенокардии (нет болей в груди или приступы стали реже);
- артериальное давление не превышает 130/80 мм рт. ст.;
- уровень общего холестерина в крови ниже 4 – 4,5 ммоль/л;
- уровень холестерина липопротеинов низкой плотности менее 2 – 2,6 ммоль/л;
- уровень глюкозы ниже 6 ммоль/л.
Если эти показатели в норме, риск повторного инфаркта миокарда снижается. Однако нельзя прекращать соблюдение режима, так как состояние может ухудшаться. Если хотя бы один из критериев не соответствует норме, необходимо обратиться к врачу. Возможно, произошли структурные изменения в сердце или развились осложнения. В таком случае общие принципы профилактики останутся прежними, но врач добавит регулярный прием определенных медикаментов.
Можно ли лечить инфаркт миокарда народными средствами?
Инфаркт миокарда — одно из самых опасных заболеваний сердечно-сосудистой системы, часто приводящее к летальному исходу. Поэтому самолечение народными средствами не рекомендуется. Во-первых, ни одно лекарственное растение не сравнится с фармакологическими препаратами по скорости действия, что критично при инфаркте. Во-вторых, многие медикаменты вводятся внутривенно, что также ускоряет лечебный эффект.
Народные средства могут быть полезны в период после инфаркта, когда у пациента сохраняются остаточные симптомы, но риск серьезных осложнений снижен. На этом этапе растительные препараты могут помочь стабилизировать работу сердца и ускорить реабилитацию.
В подостром и постинфарктном периоде можно использовать следующие народные средства:
- Лимонная цедра. Рекомендуется жевать для улучшения коронарного кровообращения и снятия болей в груди.
- Сок лука. Свежевыжатый сок лука с медом в равных пропорциях улучшает работу сердца и стабилизирует сердечный ритм. Принимают 1-2 чайные ложки 1-2 раза в день в течение 1-2 недель, затем делают перерыв.
- Настой женьшеня. Измельченный корень женьшеня с медом в соотношении 1 к 25 настаивают 5-7 дней. Принимают трижды в день по половине чайной ложки.
- Сок моркови. Смешанный с растительным маслом, морковный сок ускоряет формирование соединительной ткани в области инфаркта. Начинают применять через 4-5 дней после инфаркта, принимая по полстакана в день (на полстакана сока — 1 чайная ложка масла).
- Сердечный сбор. Сбор трав, настоянный в термосе, ускоряет восстановление в постинфарктный период. Основные компоненты: цветки клевера, лабазник, сушеница болотная, чистотел и шалфей. На 0,5 литра кипятка берется 10 г смеси трав. Смесь можно прокипятить 1-2 минуты, затем настаивать 3-4 часа. Принимают трижды в день по четверти стакана после еды.
Существуют и другие народные средства, но их объединяют несколько правил. Во-первых, ни одно из них не заменяет профессиональную медицинскую помощь и современные лекарства. Во-вторых, если вы решите использовать народные средства, обязательно сообщите об этом врачу, так как некоторые растения могут влиять на действие назначенных медикаментов, что может снизить лечебный эффект и повысить риск осложнений.
Что нельзя после инфаркта миокарда?
Инфаркт миокарда — серьезное заболевание, вызывающее множество патологических изменений в организме. Эти изменения, в сочетании с уже существующими заболеваниями, накладывают ограничения на повседневную жизнь людей, перенесших инфаркт.
После инфаркта необходимо пересмотреть некоторые аспекты жизни, чтобы избежать повторных приступов. Это касается режима дня, питания и постоянного лечения.
После инфаркта миокарда следует исключить:
- Чрезмерные физические нагрузки. Избыточная физическая активность может привести к напряжению сердца и спровоцировать новый приступ кислородного голодания. Людям, перенесшим инфаркт, не рекомендуется заниматься спортом с высокой нагрузкой. Умеренные физические нагрузки, такие как лечебная гимнастика, короткие прогулки и аэробные упражнения, могут способствовать восстановлению сердца и снижению риска тромбообразования. Постепенное увеличение физической активности возможно под наблюдением специалиста.
- Психоэмоциональный стресс. Эмоциональные нагрузки могут увеличить потребность миокарда в кислороде, что в условиях нарушенного кровообращения в коронарных артериях крайне нежелательно. Важно избегать чрезмерного психического напряжения.
- Неправильное питание. Неправильное питание — одна из основных причин атеросклероза. Употребление вредных веществ может негативно сказаться на миокарде и других органах. После инфаркта следует избегать жирной, жареной и нездоровой пищи, увеличив количество овощей и фруктов в рационе. Питание должно быть сбалансированным и полезным, без строгих диет и голодания.
- Употребление алкоголя и курение. Чрезмерное потребление алкоголя и курение — известные факторы риска для сердечно-сосудистых заболеваний. Отказ от этих привычек может улучшить качество жизни и прогноз.
- Резкие изменения климата. Следует избегать резких изменений климатических условий, так как это может вызвать неблагоприятные физиологические реакции.
Нельзя самостоятельно изменять лечение или отказываться от него. Назначенные врачом препараты необходимы для профилактики осложнений и дальнейшей терапии, их следует принимать до изменения схемы лечения врачом.
В каком возрасте чаще бывает инфаркт миокарда?
Инфаркт миокарда чаще всего встречается у людей старше 40 лет, особенно у мужчин. Это связано с атеросклеротическими изменениями в коронарных артериях, которые являются основной причиной инфаркта. В этом возрасте многие продолжают активно жить, занимаясь спортом, курением и употреблением алкоголя, что приводит к пику заболеваемости в возрасте 40-60 лет. У пожилых пациентов также часто выявляются проблемы с коронарными артериями, но они ведут более спокойный образ жизни и менее подвержены факторам, способствующим инфаркту.
В последние годы наблюдается «омоложение» инфаркта: заболеваемость среди молодежи растет, и случаи инфаркта у людей 30-40 лет становятся более частыми. В детском возрасте заболевание практически не фиксируется, а у новорожденных острые нарушения коронарного кровообращения связаны с врожденными аномалиями сосудов, а не с атеросклерозом.
При оценке риска инфаркта важно учитывать следующие факторы:
- курение (включая стаж);
- алкоголизм;
- неправильное питание (избыточное потребление животных жиров);
- высокий уровень холестерина;
- наличие случаев инфаркта в семье;
- гиподинамия (малоподвижный образ жизни);
- симптомы ишемической болезни сердца (боли за грудиной при физической нагрузке);
- сахарный диабет и другие метаболические заболевания;
- повышенное артериальное давление.
Чем больше факторов воздействует на пациента, тем выше вероятность инфаркта в молодом возрасте. Пик заболеваемости в 40-50 лет является общепринятым, но кардиолог может составить индивидуальный прогноз риска инфаркта для каждого пациента.
Бывает ли повторный инфаркт миокарда?
Инфаркт миокарда — серьезное заболевание, которое может повторяться.
В зависимости от времени возникновения повторного приступа выделяют следующие формы заболевания:
- Рецидив инфаркта миокарда. Это повторный приступ, возникающий через 3 дня до двух месяцев после первого эпизода. Обычно ухудшается кровообращение в той же области, где произошел первоначальный некроз, из-за повторного снижения кровотока по поврежденному коронарному сосуду, что увеличивает зону ишемии и приводит к отмиранию большей части сердечной мышцы.
- Повторный инфаркт миокарда. Он развивается спустя два месяца и более после первого приступа. Нарушения кровообращения происходят на фоне склеротических изменений в сердечной мышце.
Чаще всего повторный инфаркт возникает на фоне необратимых изменений в коронарных сосудах, вызванных атеросклерозом или другими хроническими заболеваниями.
Чтобы избежать рецидивов острого инфаркта миокарда, важно следовать рекомендациям врача и соблюдать диету и режим.
Профилактика повторного инфаркта миокарда включает в себя следующие меры:
- Ограничение физической активности. Физическая нагрузка может как положительно, так и негативно влиять на сердечную мышцу. Здоровое сердце переносит адекватные нагрузки, постепенно адаптируясь. Однако сердечная мышца, подвергшаяся изменениям после инфаркта, менее устойчива к нагрузкам. Поэтому людям, перенесшим инфаркт, рекомендуется ограничить физическую активность и избегать чрезмерных нагрузок. Подходящими являются занятия лечебной физкультурой и короткие прогулки.
- Здоровое питание. Неправильное питание и нарушения обмена веществ способствуют развитию атеросклероза. Чтобы снизить риск, следует избегать продуктов, богатых холестерином (животные жиры), и отдавать предпочтение растительной пище.
- Адекватное лечение. Для нормализации состояния и улучшения работы сердечной мышцы недостаточно лишь диеты и режима. Необходимо эффективное медикаментозное лечение, которое устранит основные факторы, негативно влияющие на сердце. Важно, чтобы пациент понимал, что риски побочных эффектов лекарств компенсируются их положительным терапевтическим эффектом.
Бывает ли инфаркт правого желудочка?
Инфаркт правого желудочка встречается реже, чем инфаркт левого, но требует срочной медицинской помощи из-за возможных серьезных осложнений и летального исхода.
Этот тип инфаркта возникает при нарушении кровообращения в проксимальных отделах правой коронарной артерии. Поскольку правый желудочек требует меньше кислорода, некротические изменения развиваются реже и медленнее. По статистике, инфаркт правого желудочка наблюдается в 15% случаев среди всех инфарктов.
Правый желудочек перекачивает венозную кровь в легкие, а затем в левый желудочек, обеспечивая большой круг кровообращения. Нарушение его работы сказывается на легочной системе и может привести к недостаточности левого желудочка из-за уменьшения притока крови и снижения артериального давления.
Симптомы инфаркта правого желудочка:
- Одышка. Отличается от одышки при патологии левого желудочка. При инфаркте правого желудочка кровь не насыщается кислородом, что вызывает нехватку воздуха.
- Боль за грудиной. Один из основных симптомов острого инфаркта миокарда, может отсутствовать. Обычно острая и длится 5-15 минут.
- Головокружение и потеря сознания. Возникают из-за снижения артериального давления и недостаточного кровоснабжения мозга.
- Спутанность сознания. Проявляется сонливостью, апатией, нарушениями мышления и иногда агрессией из-за кислородного голодания мозга.
- Снижение продукции мочи. Пониженное артериальное давление нарушает кровообращение в органах, что приводит к снижению мочеобразования (менее 200-150 мл в сутки).
- Синюшность конечностей. Возникает из-за недостатка кислорода в тканях и застоя венозной крови.
- Вздутие вен шеи. Снижение насосной функции правого желудочка приводит к застою венозной крови, особенно заметному на шейных венах.
Диагностика инфаркта правого желудочка основывается на инструментальных исследованиях. Наиболее информативны УЗИ сердца, электрокардиограмма (ЭКГ) и исследование коронарных артерий.
Лечение инфаркта правого желудочка направлено на восстановление нормального кровоснабжения органов, стабилизацию давления и улучшение насосной функции сердца. Важен своевременный восстановление кровообращения по поврежденным коронарным сосудам.
Как не пропустить признаки приближающегося инфаркта? Первая помощь при инфаркте
Вопрос-ответ
Каковы причины инфаркта миокарда?
Основной причиной инфаркта является закупорка (тромбоз) одной из артерий сердца, которая возникает при разрыве атеросклеротической бляшки. Среди других причин инфаркта миокарда можно выделить продолжительный спазм артерий, эмболию, сверхмерную нагрузку на орган, стресс, артериальную гипертензию (гипертонию), курение.
Какие симптомы характерны для инфаркта миокарда?
Симптомы инфаркта миокарда проявляются нестерпимой болью в грудной клетке, иногда отдающей в правое или левое плечо и руку, под лопатку, в левую половину грудной клетки, нижнюю челюсть. Боль сравнима с тяжестью или жжением и, как правило, сопровождается страхом смерти.
Что такое Инфаркт миокарда?
Острый инфаркт миокарда — самое серьёзное проявление ишемической болезни сердца. Он вызывает более 4 миллионов смертей в Европе и Северной Азии.
Советы
СОВЕТ №1
Регулярно проходите медицинские обследования, особенно если у вас есть факторы риска, такие как высокое кровяное давление, высокий уровень холестерина или семейная история сердечно-сосудистых заболеваний. Это поможет выявить проблемы на ранней стадии и предотвратить инфаркт миокарда.
СОВЕТ №2
Обратите внимание на свое питание. Употребляйте больше фруктов, овощей, цельнозерновых продуктов и нежирных белков, а также ограничьте потребление насыщенных жиров, сахара и соли. Здоровая диета способствует улучшению состояния сердечно-сосудистой системы.
СОВЕТ №3
Регулярно занимайтесь физической активностью. Умеренные физические нагрузки, такие как прогулки, плавание или занятия спортом, помогают укрепить сердечно-сосудистую систему и снизить риск инфаркта. Стремитесь к минимуму 150 минут умеренной активности в неделю.
СОВЕТ №4
Обратите внимание на симптомы, такие как боль в груди, одышка, потливость или тошнота. Если вы или кто-то рядом испытывает эти симптомы, немедленно обращайтесь за медицинской помощью. Быстрая реакция может спасти жизнь.